
| A. | 蒸发 | B. | 萃取 | C. | 液体过滤 | D. | 升华 |
分析 A.蒸发要用到的仪器有:酒精灯、蒸发皿、玻璃棒、铁架台、铁圈;
B.萃取要用到的仪器有:分液漏斗和烧杯;
C.过滤要用到的仪器有:烧杯、漏斗、玻璃棒、铁架台、铁圈、滤纸;
D.溶解用到的仪器有:烧杯、玻璃棒.
解答 解:A.蒸发实验中所用的酒精灯、蒸发皿、玻璃棒、铁架台、铁圈、坩埚钳,缺少坩埚钳,故A错误;
B.萃取操作必须使用分液漏斗和烧杯,这些仪器都已具备,可完成萃取操作,故B正确;
C.过滤要用到的仪器有:烧杯、漏斗、玻璃棒、铁架台、铁圈、滤纸,缺少滤纸不是仪器,故C正确;
D.升华要用到的仪器有:铁架台(石棉网)、酒精灯、烧瓶、石棉网,可完成,故D正确.
故选A.
点评 本题考查物质分离、提纯的方法及常见实验仪器,侧重于学生的分析能力和实验能力的考查,难度不大,注意熟悉常见实验及其所用仪器和各种仪器的作用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,44.8L乙醇中含有的分子数目为0.2NA | |
| B. | 常温常压下,6.4gSO2中含有的氧原子数目为0.2NA | |
| C. | 1L0.1mol•L-1K2CO3溶液中含有的钾离子数目为0.1NA | |
| D. | 100mL1.0mol•L-1FeCl3溶液与足量铜反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
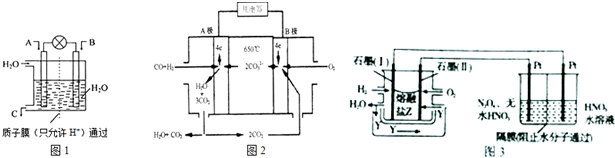
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠在电流的作用下电离出Na+和Cl- | |
| B. | CaCO3难溶于水,但CaCO3属于强电解质 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 硫酸钠在水中的电离方程式可表示为Na2SO4═2Na++S6++4O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
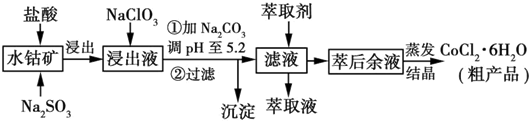
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
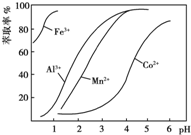
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/(L•min) | B. | 6.0mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃钢是复合材料 | B. | 铝是黑色金属材料 | ||
| C. | 石英是半导体材料 | D. | 水泥是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
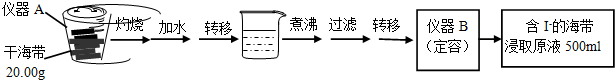
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com