
| A、Ba2++SO42-=BaSO4↓ |
| B、NH4++H++2OH-=NH3?H2O+H2O |
| C、NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3?H2O+H2O |
| D、NH4++H++2SO42-+2Ba2++2OH-=2BaSO4↓+NH3?H2O+H2O |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )
将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流表指针仍然有偏转,下列说法正确的是( )| A、图1盐桥中的阳离子移向甲装置 | ||||
| B、两图都是将化学能转变成电能的装置 | ||||
C、图2中乙装置总反应的离子方程式:Cu2++2Cl-
| ||||
| D、图2中电子流向为Fe→电流计→石墨a→石墨b→→石墨c→Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
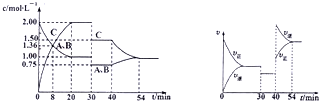
| A、前8minA的平均反应速率为0.08mol?L-1min-1 |
| B、反应方程式中的x=1,正反应为吸热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、30-40min之间该反应增大了压强或使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4和SiCl4的熔点 |
| B、I2在水中的溶解度和I2在CCl4溶液中的溶解度 |
C、对羟基苯甲醛( )和邻羟基苯甲醛( )和邻羟基苯甲醛(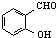 )的沸点 )的沸点 |
| D、H2SO3和H2SO4的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题:
已知A是一种只含碳、氢、氧三种元素的有机物,其蒸气的密度为相同条件下的氢气的密度的23倍.A可以和金属钠反应放出氢气并在一定条件下发生如图所示的变化.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.2 mol?L-1 |
| B、Y2为0.35 mol?L-1 |
| C、X2为0.3 mol?L-1 |
| D、Z为0.4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com