
����Ŀ����������������ˮ����ζ������������ˮ�㾫�����쾫�ͣ�Ҳ��������ʳƷ�У�ʵ�����Ʊ��������£�

���������ֲ�Ʒ���Ʊ�
�ڸ����50 mL����Բ����ƿ�У�����6.1g�����ᡢ������ˮ�Ҵ���8 mL����1mLŨ���ᣬҡ�Ⱥ�ӷ�ʯ����װ��ˮ����ˮԡ���ȣ���ʼ���ƻ����ٶ�1��2 d/s����Ӧʱ��һ�Ҵ���ˮ���γɡ������������������Ȼ���Լ1Сʱ������ˮ���в�����Сˮ������ʱ��ֹͣ���ȡ���Ϊ����װ�ã����������Ҵ��ͱ���
�е㣨�棩 | ��Է������� | |
������ | 249 | 122 |
���������� | 212��6 | 150 |
��1��д������������18O��ǵ��Ҵ�������Ӧ�ķ���ʽ___________________��
��2��װ��A�����Ƽ���ˮͨ���_________________________��
��3��ͨ����ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��Ŀ����___________________������ʲô��������ʵ��ͬ����Ŀ��_____________(�δ�����)��
��4��ʵ�������û�мӷ�ʯ����д�����ӷ�ʯ�IJ���___________________��
��5��ͼ��װ���еĴ���______________________��
��.�����������ľ���
�������������ֲ�Ʒ�����·������о��ƣ�����ƿ�е�Һ�嵹��ʢ��30 mL��ˮ���ձ��У������·������뱥��Na2CO3��Һ������ϸ�ķ�ĩ�����������������pH��ֽ����²���Һ�����ԡ��÷�Һ©���ֳ��ֲ��ˮ�������ѣ�10 mL����ȡ���ϲ��л��࣬����ˮCaCl2��������Ĵֲ�������ˮԡ�������ѣ��ٸ��ü�ѹ�����ռ���֡�
��6�����뱥��̼������Һ���˿��Խ��ͱ����������ܽ���⣬���е�������__________��
��7�����վ�����IJ������У���ò�Ʒ���Ϊ5mL�������������ܶ�Ϊ1.05gcm��3����ʵ��IJ���Ϊ_________��
���𰸡�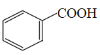 +CH3CH218OH
+CH3CH218OH![]()
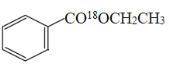 +H2O ���������ܣ�a ʹƽ�����ƣ���߱����������IJ��� ���������в��Ϸ��뱽����������ʹ�ù����Ҵ� ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ �¶ȼ�λ�ã�����ˮ������ ��ȥ���� 70%
+H2O ���������ܣ�a ʹƽ�����ƣ���߱����������IJ��� ���������в��Ϸ��뱽����������ʹ�ù����Ҵ� ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ �¶ȼ�λ�ã�����ˮ������ ��ȥ���� 70%
��������
��1��������Ӧʱ�����ǻ��ʹ����ǻ�����������ˮ���ʱ���������18O��ǵ��Ҵ�������Ӧ�ķ���ʽΪ +CH3CH218OH
+CH3CH218OH![]()
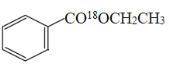 +H2O��
+H2O��
��2��װ��AΪ���������ܣ�����ˮ�½��ϳ����ʴ�Ϊ�����������ܣ�a��
��3��ͨ����ˮ�����Ϸ����ȥ��Ӧ���ɵ�ˮ��Ŀ����ʹƽ�����ƣ���߱����������IJ��ʣ�Ҳ�����ô��������в��Ϸ��뱽����������ʹ�ù����Ҵ��ȷ������ʴ�Ϊ��ƽ�����ƣ���߱����������IJ��ʣ����������в��Ϸ��뱽����������ʹ�ù����Ҵ���
��4�����ӷ�ʯ�IJ�����ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ���ʴ�Ϊ��ֹͣ���ȣ���Һ����ȴ�ӷ�ʯ��
��5��ͼ��װ�����¶ȼ�û�з�����������ƿ֧�ܿڳ�����������Ϊ�˳������ˮ������ӦΪ�½��ϳ����ʴ�Ϊ���¶ȼ�λ�ã�����ˮ�����ڣ�
��6������̼������Һ���˿��Խ��ͱ����������ܽ���⣬���е������dz�ȥ���ᣬ�ʴ�Ϊ����ȥ���
��7������������ʵ�ʲ���![]() �����������ʵ���
�����������ʵ���![]() �������۲���
�������۲���![]() ������=
������=![]() ���ʴ�Ϊ��70%��
���ʴ�Ϊ��70%��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ��������������ͼ��ʾ����֪��Ӧ�еõ��IJ����мӹ���I2��õ�������Һ��������Ũ��I2��H2SO4��ͺ���Ũ��I2��HI�㣬������ֱ���з�Ӧ��������ѭ���ֽ����⡣����˵���������( )
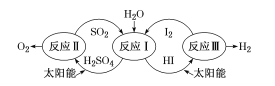
A.��ӦI�Ļ�ѧ����ʽΪ SO2+2H2O+I2=H2SO4+2HI
B.�����̽�̫����ת��Ϊ��ѧ�ܣ��ҽ�����ˮ�ֽ�����Ļ��
C.H2SO4���HI���ڼ�I2֮ǰ�ͼ�I2֮����ֳ����㣬�������ܶȡ���ɫ������ͬ
D.SO2��I2�Ƿ�Ӧ 2H2O =2H2+O2�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.���ᱡ�ɴ���(![]() )���ܷ���ˮ�⡢��������ȥ��Ӧ
)���ܷ���ˮ�⡢��������ȥ��Ӧ
B.��ȩ�ͱ�ϩȩ(![]() )����ͬϵ�������������ַ�Ӧ��IJ���Ҳ����ͬϵ��
)����ͬϵ�������������ַ�Ӧ��IJ���Ҳ����ͬϵ��
C.��֪�����ۻ���Ϊ6.0kJ/mol�������������Ϊ20kJ/mol������ÿĦ��������2mol��������ۻ�����ȫ���ڴ��Ʊ�������������ֻ���ƻ�����15%�����
D.CH3COOCH2CH3��CH3CH2COOCH3��Ϊͬ���칹�壬1H��NMR����ʾ���߾������ֲ�ͬ����ԭ����������ԭ�ӵı�����ͬ���ʲ�����1H��NMR������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��100�����¶���(�����漰����Һ�¶Ⱦ�Ϊ100��)��ˮ�����ӻ�KW��1��10��12������˵����ȷ����
A.0.001 mol/L��NaOH��ҺpH��9
B.0.1 mol/L��H2SO4��ҺpH��1
C.0.005 mol/L��H2SO4��Һ��0.01 mol/L��NaOH��Һ�������ϣ������ҺpHΪ6����Һ������
D.��ȫ�к�pH��3��H2SO4��Һ50 mL����ҪpH��11��NaOH��Һ50 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ���
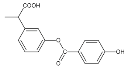
�ٷ���ʽΪC16H14O5 ����ʹ���Ը��������Һ��ɫ ���ܷ����ӳɷ�Ӧ�������ܷ���ȡ����Ӧ �ܱ����ϵ�һ�������6�� ��1mol ���л�����NaOH��Ӧʱ�������4mol NaOH ��1mol���л�����һ�������º�H2��Ӧ��������6molH2
A.�٢ڢۢ�B.�٢ڢۢ�C.�٢ۢܢݢ�D.�٢ڢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ĺ������кܶ��֣������������ᡢ�������⣬���кܶ������ᣬ�罹������(H2S2O5)����һ����(H2SO5) ��������(H2S2O8) �ȡ���һ������һ��һԪǿ�ᣬ��������Ӿ����������ṹʽ��ͼ��ʾ������������һ�ְ�ɫ���壬�����ֽ⣬��ǿ��ˮ�ԣ���������ˮ����ˮ�л���ˮ��õ�����������⣬��ش�����������⡣
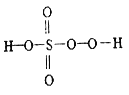
(1)��һ��������Ԫ�صĻ��ϼ���_________����������Ľṹʽ��_____________��
(2)��ҵ���Ʊ�����������Һ������֮һ���£�
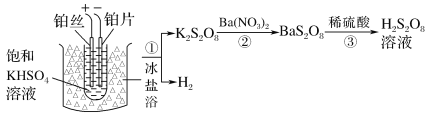
�ٵ��ʱ�����ĵ缫��ӦʽΪ______
�����������ܷ���ͭ˿���沬˿��________(������������������)��˵�����ɣ�__________��
(3)����������(Na2S2O5)����Ҫ�Ŀ�����������ҵ�������̵����е�SO2����Na2S2O5�Ĺ���Ϊ��
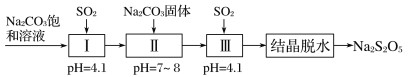
��pH��4.1ʱ������Ϊ________��Һ(д��ѧʽ)��
�ڹ����м���Na2CO3���壬���ٴγ���SO2��Ŀ����___________��
�����ѾƳ���Na2S2O5�������������ڲⶨij���Ѿ���Na2S2O5������ʱ��ȡ50.00 mL���Ѿ���Ʒ����0.010 00 mol��L��1�ĵ��Һ�ζ����յ㣬����10.00 mL���ζ���Ӧ�����ӷ���ʽΪ_______________ ������Ʒ��Na2S2O5�IJ�����Ϊ______g��L��1(��SO2��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����ʵ��˵��HNO2��������ʵ���
��HNO2��Һ��NaHCO3��Һ��ϣ��ų�����
����HNO2��Һ��������ʵ�飬���ݺܰ�
��HNO2��Һ����Na2SO4��Һ��Ӧ
��0.1mol��L -1HNO2��Һ�У�c(H��)��0.015mol��L-1
����ͬŨ��ʱ��HNO2��Һ�ĵ���������������
��ȡ0.1mol��L -1HNO2��Һ200mL����ˮ�����Ϊ2L��pH>2
A.�٢ڢ�B.�ܢݢ�C.�٢ۢ�D.�٢ܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ����������
A.pH��2����Һ��Na+��Fe3+��Cl����NO3-
B.c(NaAlO2)��0.1mol��L��1����Һ��K+��H+��Cl����SO42-
C.c(OH)<![]() ����Һ��Na+��K+��SiO32-��ClO��
����Һ��Na+��K+��SiO32-��ClO��
D.c(Fe3+)��0.1mol��L��1����Һ��Al3+��NO3-��MnO4-��SCN��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����龧��ľ����ṹ��ͼ��ʾ������˵����ȷ���ǣ� ��

A.���龧���е���ֻ����1��Cԭ��
B.������1��CH4������Χ��12�����ڵ�CH4����
C.���龧���ۻ�ʱ��˷����ۼ�
D.1��CH4�������8��CH4����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com