
����Ŀ������ͭ��һ������Ũ���ᷴӦ���õ�����ͭ��Һ��NO2��NO�Ļ������2.24L����״��������Щ������һ�����O2����״������Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᣮ������������ͭ��Һ�м���4molL��1NaOH��Һ��Cu2+ǡ����ȫ������������NaOH��Һ�������50mL������˵����ȷ���ǣ� ��
A.�μӷ�Ӧ��������0.4mol
B.�������������Ϊ1.68 L
C.�˷�Ӧ������ת�Ƶĵ���Ϊ0.3 mol
D.��������к�NO21.12 L
���𰸡�D
���������⣺�����2.24L�����������ʵ���Ϊ�� ![]() =0.1mol��50mL 4mol/L������������Һ���������Ƶ����ʵ���Ϊ��4mol/L��0.05L=0.2mol��
=0.1mol��50mL 4mol/L������������Һ���������Ƶ����ʵ���Ϊ��4mol/L��0.05L=0.2mol��
A��ͭ����ǡ�ó���ʱ����Ӧ�������Ϊ�����ƣ������������غ��֪����������������ӵ����ʵ���Ϊ0.02mol�����ݵ�ԭ���غ�ɵ���������ʵ���Ϊ��0.1mol+0.2mol=0.3mol����A����
B������������ͭ�����ʵ���Ϊ��0.2mol�� ![]() =0.1mol����Ӧ���ĵ�ͭ�����ʵ���Ϊ0.1mol��0.1molͭ��ȫ��Ӧʧȥ0.2mol���ӣ����ݵ����غ㣬�����õ��ĵ�����ͭʧȥ�ĵ���һ����ȣ����������������ʵ���Ϊ��
=0.1mol����Ӧ���ĵ�ͭ�����ʵ���Ϊ0.1mol��0.1molͭ��ȫ��Ӧʧȥ0.2mol���ӣ����ݵ����غ㣬�����õ��ĵ�����ͭʧȥ�ĵ���һ����ȣ����������������ʵ���Ϊ�� ![]() =0.05mol�����ı�������������Ϊ��22.4L/mol��0.05mol=1.12L����B����
=0.05mol�����ı�������������Ϊ��22.4L/mol��0.05mol=1.12L����B����
C������B�ķ�����֪����Ӧת�Ƶĵ���Ϊ0.2mol����C����
D����NO�����ʵ���Ϊx���������������ʵ���Ϊy����x+y=0.1�����ݵ����غ�ɵã�3x+y=0.2����ã�x=0.05mol��y=0.05mol�����Ի�������ж������������Ϊ1.12L����D��ȷ��
��ѡD��
�����2.24L�����������ʵ���Ϊ�� ![]() =0.1mol��50mL 4mol/L������������Һ���������Ƶ����ʵ���Ϊ��4mol/L��0.05L=0.2mol��
=0.1mol��50mL 4mol/L������������Һ���������Ƶ����ʵ���Ϊ��4mol/L��0.05L=0.2mol��
A��ͭ����ǡ�ó���ʱ����Ӧ�������Ϊ�����ƣ������������غ��֪����������������ӵ����ʵ���Ϊ0.02mol���ٸ��ݵ�ԭ���غ�ɵ���������ʵ�����
B������������ͭ�����ʵ���Ϊ��0.2mol�� ![]() =0.1mol����Ӧ���ĵ�ͭ�����ʵ���Ϊ0.1mol��0.1molͭ��ȫ��Ӧʧȥ0.2mol���ӣ����ݵ����غ㣬�����õ��ĵ�����ͭʧȥ�ĵ���һ����ȣ����ݵ����غ����������������ʵ������ټ�����������
=0.1mol����Ӧ���ĵ�ͭ�����ʵ���Ϊ0.1mol��0.1molͭ��ȫ��Ӧʧȥ0.2mol���ӣ����ݵ����غ㣬�����õ��ĵ�����ͭʧȥ�ĵ���һ����ȣ����ݵ����غ����������������ʵ������ټ�����������
C������B�ķ�����֪��Ӧת�Ƶĵ��ӵ����ʵ�����
D����NO�����ʵ���Ϊx���������������ʵ���Ϊy���ֱ����������������غ���ʽ���㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪XԪ�ص�ԭ�ӵ�K��L��ĵ�����֮�ͱ�L��M��ĵ�����֮�Ͷ�1�����ӣ�YԪ�ص�ԭ���������������ڲ��������3����ZԪ�غ�����3�����Ӳ㣬�������3�����ӣ�WԪ������ϼ�����ͻ��ϼ۾���ֵ��3������������������е���������Ϊ40%��
��1��Y��W����̬�⻯����ȶ��ԣ��û�ѧʽ��ʾ����
��2���õ���ʽ��ʾX��W�γɻ�����Ĺ���
��3��X�����ڿ����м������ɵĻ�����ĵ���ʽ
��4��X��Z������������Ӧˮ���ﷴӦ�����ӷ���ʽ
��5��Y��Z�γɻ�����Ļ�ѧʽ�� �� ʵ���õ��˻����ﴦ�ڹ�̬��Һ̬ʱ�����磬����ˮ�ܵ��磮�ɴ��жϸû�����������������ӻۣ�
��6��W�ĵͼ���������Y���ʵ�ˮ��Һ��Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ�ܵ��磬�������ڵ���ʵ���
A. ������ B. ���� C. ���� D. �Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������л��軯������ķ���������������ƣ�����˵���������(����)
A.����ķ���ʽΪSiH4
B.����ȼ������SiO2��H2O
C.������ܶȱȼ���С
D.��������ȶ��Աȼ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���;�������ֵ����ʶ�Ӧ��ϵ����������( )
���� | ��; | ���ֵ����� | |
A | SO2 | �������� | ��ԭ�� |
B | NH3 | ����̼����� | ��ԭ�� |
C | SiO2 | ��ȡ�赥�� | ������ |
D | Fe2O3 | ұ�������� | ������ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£��赥�ʺ�HCl��Ӧ����SiHCl3�Ǵֹ��ᴿ����Ҫ���裮ijС�������ͼ��ʾװ���������ת�����г�װ����ȥ���� 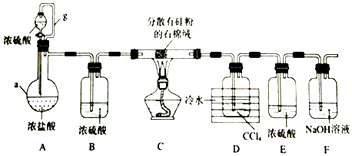
��֪��SiHCl3�ķе�Ϊ33.0��C���������л��ܼ�������ˮ���ҷ�Ӧ���ڿ������ױ�������CCl4�ķе�Ϊ76.8��C��
��ش�
��1������a������������g��������
��2��װ��A�У�Ũ�������ֵ�����Ϊ��ʵ��ʱ�����ȴ�Һ©��������һ��ʱ����ڵ�ȼC���ƾ��ƣ���������
��3��װ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��
��4��װ��D�����õ�Һ̬�����ķ��뷽��Ϊ �� ����������ƣ�
��5����Ӧ�������ͨ��װ��F�е�NaOH��Һ���ݳ�����Ĵ�������Ϊ��
��6��SiHCl3�ڳ�ʪ�Ŀ����б�����������һ���������һ�������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������к���Cr��OH��3��Al2O3��ZnO��CuO��NiO�����ʣ���ҵ��ͨ���������̻���Na2Cr2O7�����ʣ� 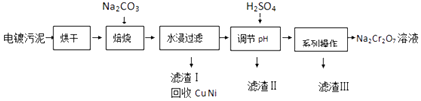
��֪��
��Cr��OH��3��ZnO��Al2O3һ����Ϊ���Ի����
��Na2Cr2O7��Na2SO4�ڲ�ͬ�¶��µ��ܽ�������
20�� | 60�� | 100�� | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
��1�����չ���������Na2CrO4�Ļ�ѧ����ʽΪ��ˮ������Һ�г�Na2CrO4�����ڵ�����������
��2������H2SO4����pH��Ŀ��Ϊ��
��3���õ�������ġ�ϵ�в������IJ���Ϊ�����ˣ�
��4����1L����H2SO4��������Һ�к���Ԫ������Ϊ23.4g��CrO42����8/9ת��ΪCr2O72�� �� ��ת����������Һ��c��Cr2O72����=molL��1��
��5����Na2Cr2O7��H2SO4���Һ�м���H2O2 �� �ټ������Ѳ�ҡ�������Ѳ�Ϊ��ɫ������������CrO5 �� ������Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A.���������֮�͵��������ɸ߾��������
B.����Ϊһ������ʱ�����巢���Ӿ۷�Ӧ
C.���۷�Ӧ�ĵ�����������������
D.���ۺ���ά�ص����ڶ���C6H10O5 �� ���ۺ϶Ȳ�ͬ���˴˲���ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ܸ�ϡ���ᷴӦ�����ܸ�NaOH��Һ��Ӧ����(����)
��Al2O3����Mg(OH)2����Al(OH)3����NaHCO3 ��AlCl3
A. �٢ۢ� B. �٢ۢ� C. ֻ�Т٢� D. ֻ�Тڢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com