
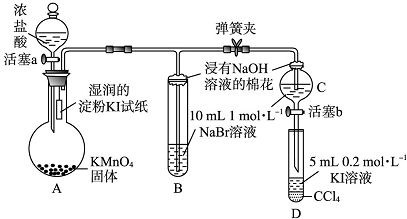
分析 验证卤素单质氧化性的相对强弱,装置A:高锰酸钾溶液和浓盐酸反应生成氯化锰、氯化钾、氯气和水,装置A中生成氯气,烧瓶上端湿润的碘化钾淀粉试纸变蓝色,验证氯气的氧化性强于碘,装置B:装置B中盛有溴化钠,氯气进入装置B中,氯气氧化溴离子为溴单质,溶液呈橙红色,验证氯的氧化性强于溴,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气,当B和C中的溶液都变为黄色时,夹紧弹簧夹,为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论.
(1)氯气颜色为黄绿色,高锰酸钾具有强氧化性,与浓盐酸反应生成氯气;
(2)氯气氧化性强于单质碘,碘遇淀粉变蓝色;
(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成;
(4)如CCl4层溶液变为紫红色,则说明有碘生成;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰;
(6)从原子结构(电子层数、原子半径)的角度分析.
解答 解:验证卤素单质氧化性的相对强弱,装置A:高锰酸钾溶液和浓盐酸反应生成氯化锰、氯化钾、氯气和水,装置A中生成氯气,烧瓶上端湿润的碘化钾淀粉试纸变蓝色,验证氯气的氧化性强于碘,装置B:装置B中盛有溴化钠,氯气进入装置B中,氯气氧化溴离子为溴单质,溶液呈橙红色,验证氯的氧化性强于溴,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气,当B和C中的溶液都变为黄色时,夹紧弹簧夹,为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论.
(1)黄绿色气体为氯气,由高锰酸钾和浓盐酸发生氧化还原反应生成氯化锰、氯化钾、氯气和水,方程式为:16HCl(浓)+2KMnO4═2MnCl2+2KCl+5Cl2↑+8H2O,
故答案为:16HCl(浓)+2KMnO4═2MnCl2+2KCl+5Cl2↑+8H2O;
(2)淀粉变蓝色,说明有单质碘生成,说明氯气氧化性强于单质碘,
故答案为:淀粉KI试纸变蓝;
(3)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-═Br2+2Cl-,
故答案为:Cl2+2Br-═Br2+2Cl-;
(4)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色,
故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡,静至后CCl4层溶液变为紫红色;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,
故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,
故答案为:原子半径逐渐增大.
点评 本题主要考查了卤素单质氧化性的相对强弱的验证,根据实验现象并用卤素性质进行解释是解答关键,注意要排除干扰因素的存在,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| C. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 | |
| D. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
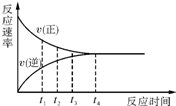 一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随时间的变化如图所示,下列判断正确的是( )
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随时间的变化如图所示,下列判断正确的是( )| A. | t1时刻,v(正)<v(逆) | B. | t2时刻,v(正)>v(逆) | C. | t3时刻,v(正)=v(逆) | D. | t4时刻,v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 20.00 | 0.00 | 22.20 |
| 第二次 | 20.00 | 1.56 | 25.50 |
| 第三次 | 20.00 | 0.22 | 22.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于稀盐酸中:Ca2++2H+=Ca2++H2O+CO2↑ | |
| B. | 向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 铜片跟稀硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、O2、HCl | B. | N2、H2、HCl | C. | CO2、NO、O2 | D. | H2S、O2、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6.-2 | -1 | -1 |
| A. | 气态氢化物的稳定性HG>HF>H2E | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | A、E元素与氧元素可以形成三种常见的含氧酸盐 | |
| D. | F、G元素的氢化物沸点G>F |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
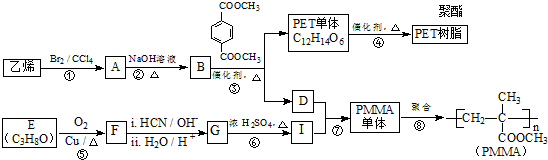
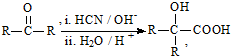 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. .
.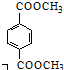 与足量NaOH溶液反应时,最多消耗4molNaOH
与足量NaOH溶液反应时,最多消耗4molNaOH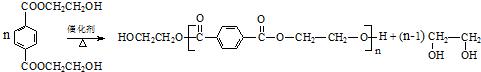 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com