
| n |
| V |
| n |
| V |


 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�����Ҷ�����ȡ�߷��� ��ͨ���Ӿ۷�Ӧ��ɵ� ��ͨ���Ӿ۷�Ӧ��ɵ� |
| B���Ҵ���Ũ���������������Ҽ��ȵ�������һ��������ȥ��Ӧ |
| C��±����һ����˵��NaOH��ˮ��Һ���ܷ���ȡ����Ӧ������NaOH�Ĵ���Һ�в�һ���ܷ�����ȥ��Ӧ |
| D������������һ��������ˮ��һ���õ���Ӧ������ʹ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
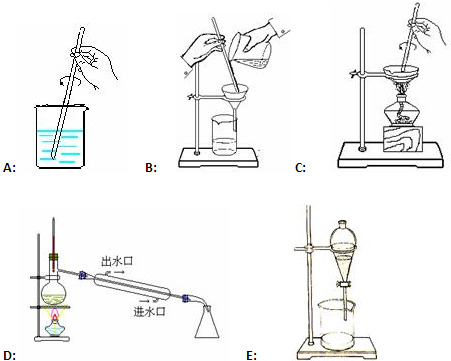
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 4 |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A | B | |
| C | D |
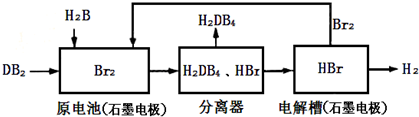
| ��ѧʽ | Ag2SO4 | AgBr |
| �ܽ�ȣ�g�� | 0.796 | 8.4��10-6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
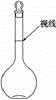 ��3����ʵ���õ��Ļ������������ձ�����ƽ�������롢���ӣ�������������ȱ�ٵ�������
��3����ʵ���õ��Ļ������������ձ�����ƽ�������롢���ӣ�������������ȱ�ٵ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 1��91 |
| pH | 8.2 | 7.2 | 6.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com