
| A. | 烷烃 | B. | 烯烃 | C. | 芳香烃 | D. | 卤代烃 |
分析 有机物按碳的骨架分类:
1.链状化合物:这类化合物分子中的碳原子相互连接成链状,因其最初是在脂肪中发现的,所以又叫脂肪族化合物,其结构特点是碳与碳间连接成不闭口的链;
2.环状化合物:环状化合物指分子中原子以环状排列的化合物.环状化合物又分为脂环化合物和芳香化合物;(1)脂环化合物:不含芳香环(如苯环、稠环或某些具有苯环或稠环性质的杂环)的带有环状的化合物,如环丙烷、环己烯、环己醇等;
(2)芳香化合物:含芳香环(如苯环、稠环或某些具有苯环或稠环性质的杂环)的带有环状的化合物,如苯、苯的同系物及衍生物等,
根据以上知识进行判断.
解答 解:A.烷烃为饱和烃,有机物分子中碳原子数相同时烷烃的含氢量最大,是按照H的饱和程度进行分类,不是按照碳架分类的,故A错误;
B.烯烃分子中含有官能团碳碳双键,烯烃是按照官能团种类进行分类的,故B错误;
C.芳香烃中含有苯环的烃,属于环状化合物中的芳香化合物,是按照碳架分类的,故C正确;
D.烃中氢原子被卤素原子取代后生成的化合物称为卤代烃,卤代烃是按照官能团种类分类的,故D错误;
故选C.
点评 本题考查了有机物分类方法及有机物中碳的成键特征,题目难度不大,明确常见有机物的结构与分类方法为解答关键,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.11 | B. | 22.22 | C. | 30.00 | D. | 32.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应为放热反应 | |
| B. | 该反应可为Ba(OH)2•8H2O与NH4Cl晶体的反应 | |
| C. | 该反应可为甲烷在氧气中的燃烧反应 | |
| D. | 该反应只有在加热条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
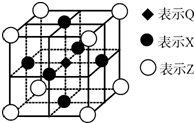 已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥⑦⑧ | B. | ③④⑤⑥⑦⑧ | C. | ①②③⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1<C2<C3 | B. | C1=C2>C3 | C. | C1>C2>C3 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com