
| A、pH<7的溶液 |
| B、c(H+)>c(OH-)的溶液 |
| C、能与金属Al反应放出H2的溶液 |
| D、滴加酚酞后显无色的溶液 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )
在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )| A、NO2和水 |
| B、SO2和NaOH溶液 |
| C、NH3和稀盐酸 |
| D、Cl2和饱和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
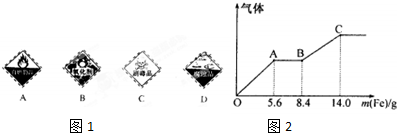 研究硫及其化合物的性质具有重要意义.
研究硫及其化合物的性质具有重要意义.| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、NaHSO3、Na2SO3 | SO3、X、NaHSO4、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、②③④⑤ |
| C、①③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
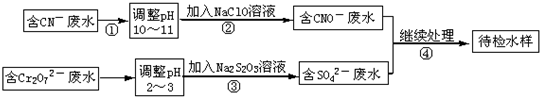
| 1 |
| 2 |
2- 7 |
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
| B、酸性溶液中可能大量存在Na+、ClO-、SO42-、I- |
| C、常温下在c(H+)=1×10-13 mol?L-1的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3- |
| D、加入铝粉能产生氢气的溶液中大量存在NH4+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用弱酸的电离平衡常数比较同温同物质的量浓度下强碱弱酸盐溶液的碱性强弱 |
| B、常温下pH=2的盐酸、氯化铵两种溶液中,水的电离程度相同 |
| C、用化学反应平衡常数推断该化学反应的剧烈程度 |
| D、将等体积、等pH的氢氧化钠溶液和氨水溶液分别稀释相同倍数,氨水的pH变化大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com