
(12分)在298K、100kPa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的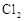 约有三分之一与水反应。请回答下列问题:
约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为______________________________________;
(2)估算该反应的平衡常数________________(列式计算,写明解题过程,否则不得分);
(3)在上述平衡体系中加入少量 固体,平衡将向________移动;
固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”“减少”或“不变”),平衡将向_________移动。
(5)氯气溶于水达到饱和后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c( )减小
)减小
B.通入少量HCl,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(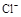 )+c(
)+c( )
)
D.加入少量CaCO3,溶液漂白性增强
(12分)(1)Cl2+H2O H++Cl-+HClO(2分)
(2)
H++Cl-+HClO(2分)
(2)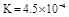 (4分)
(4分)
(3)正反应方向(或右)(1分) (4)增大、正反应方向(或右)(2分) (5)D(3分)
【解析】(1)根据题意该反应是可逆反应,所以方程式是Cl2+H2O H++Cl-+HClO。
H++Cl-+HClO。
(2)由于“溶于水的Cl2约有三分之一与水反应”,所以平衡时溶液中氯气、氯化氢和次氯酸的物质的量分别是0.06mol、0.03mol和0.03mol。其浓度分别是(mol/L)0.06、0.03、0.03,所以平衡常数K=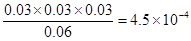 。
。
(3)氢氧化钠能中和氢离子,降低氢离子浓度,平衡向正反应方向移动。
(4)正反应是体积减小的,所以增大压强平衡向正反应方向移动,增大氯气的浓度。
(5)溶液已知达到平衡状态,所以再通入少量氯气,c(H+)/c( )不变,A不正确;通入少量HCl,氢离子浓度增大,平衡向逆反应方向移动,次氯酸的浓度降低,漂白性降低,B不正确;加入氢氧化钠,溶液不一定显中性,所以根据电荷守恒可知,C不一定正确;碳酸钙能和盐酸反应,但和次氯酸不反应,所以平衡向正反应方向移动,次氯酸浓度增大,漂白性增强,答案选D。
)不变,A不正确;通入少量HCl,氢离子浓度增大,平衡向逆反应方向移动,次氯酸的浓度降低,漂白性降低,B不正确;加入氢氧化钠,溶液不一定显中性,所以根据电荷守恒可知,C不一定正确;碳酸钙能和盐酸反应,但和次氯酸不反应,所以平衡向正反应方向移动,次氯酸浓度增大,漂白性增强,答案选D。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)?N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)?N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com