
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3在人体中的作用是( )
A.作氧化剂B.作还原剂
C.既作氧化剂又作还原剂D.既不作氧化剂又不作还原剂
科目:高中化学 来源: 题型:
【题目】(1)下列仪器使用前必须检查是否漏水的有_________(填序号)。
A.容量瓶 B.蒸馏烧瓶 C.分液漏斗 D.量筒 E.蒸发皿
(2)实验室用Na2CO3·10H2O晶体配制0.5mol/L的Na2CO3溶液970mL,应选用的容量瓶的规格___________,应称量多少克Na2CO3·10H2O晶体_____。
(3)某学生欲用10mol·L-1浓盐酸和蒸馏水配制500mL物质的量浓度为5mol·L-1的稀盐酸。则所需要浓盐酸体积为___mL,配制过程中正确的操作顺序是(字母表示,每个字母只能用一次)_________
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)配制一定体积、一定物质的量浓度的溶液,实验结果偏高影响的是_______
A.容量瓶中原有少量水 B.溶解所用烧杯未洗涤 C.定容时仰视观察刻度线 D.定容时俯视观察刻度线
(5)下图是某同学在实验室配制该NaCl溶液的过程示意图,其中有错误的是______(填操作序号)。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如下:


(1)A的名称是_______________,A分子中最多有_____个原子共平面。
(2)B生成A的化学方程式______________________。
(3)D生成E的反应类型为_________,试剂a是_________。
(4)F的结构简式_____________________。
(5)J是一种酯,分子中除苯环外还含有一个五元环。写出H生成J的化学方程式_____(注明反应条件)。
(6)![]() ,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
(7)利用题中信息和所学知识,写出以甲烷和化合物D为原料,合成 ![]() 的路线流程图____________________(其它试剂自选)。
的路线流程图____________________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列药品对应的临床应用正确的是( )
A. 麻黄碱适合于医治因葡萄球菌和链球菌等引起的血毒症
B. 毒品就是有毒的药品
C. 我国明代医学家李时珍所著的医学名著是《神农本草经》
D. 麻黄碱是国际奥委会严格禁止使用的兴奋剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在标准状况下的四种气体①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,密度最大的是_____(填序号)。
(2)标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为7.6g,则混合气体中甲烷的体积分数为_______。
(3)某物质A加热时按化学方程式2A═2B+C+3D分解,产物均为气体,测得由生成物组成的混合物气体对H2的相对密度为20,则反应物A的摩尔质量为____________。
(4)80 g密度为1 gcm-3的CaCl2溶液里含2 g Ca2+,从中再取出一半的溶液中Cl-的物质的量浓度是_______。
(5)10 mL 0.1 mol·L-1 BaCl2溶液恰好使相同体积的硫酸铁、硫酸铜两种溶液中的SO42-完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的说法正确的是( )
A.原子晶体中一定不含分子间作用力
B.离子晶体中一定只含离子键
C.分子晶体中一定含化学键
D.金属晶体的熔沸点一定高于分子晶体的熔沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2是一种性能优良的半导体光催化剂,能有效地吸附有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质。
(1)Ti基态核外电子排布式为________________。
(2)甲醛HCHO分子空间构型为_____;分子中碳原子轨道杂化类型为_____,π键和σ键的个数之比为____,
(3)氨气极易溶于水,是因为氨和水的分子均是_________,还因为___________。
(4)甲苯分子中能够共平面的原子最多为____个;苯环不易被卤素加成,而比较容易被卤素取代苯环上的氢,原因是___________________。
(5)含CN-的污水毒性极大,用NaClO先把CN-氧化为CNO-,然后在酸性条件下再将CNO-氧化为无污染的气体。请写出与CNO-互为等电子体的微粒______分子或离子,写一种)。
(6)Ti[(CN)4]2-中Ti2+与CN-的C原子形成配位键。不考虑空间构型,Ti[(CN)4]2-的结构可表示为_____________________。
(7)Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+ 处于立方体的中心)。该晶体中,Ti4+和周围____ 个O2-相紧邻;若该晶胞的密度为dg/cm3则钛氧键的键长为______pm (用带NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子可以在溶液中大量共存的是( )
A.K+、Mg2+、SO42﹣、OH﹣
B.Na+、H+、Cl﹣、HCO3﹣
C.K+、Ag+、NO3﹣、Cl﹣
D.K+、Cu2+、SO42﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
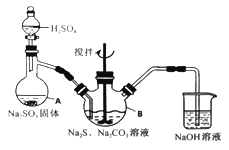
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
……
(1)写出仪器A的名称_______。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH <7,请用离子方程式解释原因_________。
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式________。
(4)从上述生成物混合液中获得较高产率Na2S2O3·5H2O的步骤为

为减少产品的损失,操作①为趁热过滤,“趁热”的原因是______;操作②是______;操作①是抽滤、洗涤、干燥。
(5)测定产品纯度
取6.00g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-。相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
滴定时,达到滴定终点的现象是___________。产品的纯度为____________。
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com