

| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

分析 制备一硝基甲苯:先配制混合溶液(即混酸)共20mL,因反应液体沸点较低,加热时容易发生暴沸,所以在三颈瓶中加入沸石,然后加入10ml甲苯(易挥发沸点为110.6℃),再向三颈瓶中加入混酸,水浴(水的沸点100℃)目的能均匀加热,且便于控制反应速率,温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;两种一硝基化合物都为有机物,所以只能利用它们沸点的不同采用蒸馏的方法分离,经提纯最终得到纯净的一硝基甲苯.
(1)混合溶液的配制可参照浓硫酸的稀释.
(2)装置A是为了将蒸汽冷却为液体再回流到三颈瓶中,冷凝水的流向通常与蒸汽的流向相反,这样保证能更充分交换热量,确保蒸汽充分冷凝;为方便控制温度通常不直接采用酒精灯加热,改用间接加热的方式加热;
(3)①因为分离得到的是无机和有机两种液体,而有机物和无机物是不相溶的,因此方法是分液;分离两种一硝基化合物只能利用它们沸点的不同,因此采用蒸馏的方法;
②经过操作Ⅰ分液得到的有机混合物中仍混有无机酸,可借助酸碱中和将它们转化为易溶于的盐,然后用水洗涤除去,加CaCl2的作用可考虑从CaCl2具有吸水性方面考虑;
(4)根椐化学变化中原子守恒规律,先计算出实验中生成硝基甲苯的理论产量,再根据产率计算实际产量.
解答 解:(1)配制混合溶液时,操作流程与浓硫酸的稀释一样,分别量取5 mL和15mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌,配制混合溶液(即混酸)共20mL,故答案为:将15mL浓硝酸注入烧杯中,再沿烧杯内壁注入5mL浓硫酸,边加边搅拌;
(2)装置球形A为冷凝管用于将蒸汽冷却为液体再回流到三颈瓶中,蒸馏时,冷却水从冷凝管的下口通入,上口流出,可使冷凝管充满冷水而进行充分冷却,所以冷却水从冷凝管的a端进入,用酒精灯直接加热很能控制温度约为50℃,可利用水浴加热并通过温度计控制水的温度,故答案为:球形冷凝管;a;水浴加热;
(3)①最初的混合液为无机和有机两种液体混合物,彼此间不相溶,可选择分液的方法进行分离;进行操作Ⅵ时分离的是两种一硝基化合物,彼此混溶,只能利用它们沸点的不同,采用蒸馏的方法分离,故答案为:分液;蒸馏;
②操作Ⅰ分液得到的有机混合物中仍混有硫酸和硝酸,可利用5%氢氧化钠溶液中和二种酸,再用水洗涤生成的盐就可以了,一硝基苯中混有少量水,因CaCl2具有吸水性,可加CaCl2吸水,达到干燥的目的,故答案为:除去硝基甲苯中的硫酸和硝酸;干燥硝基甲苯;
(4)根椐原子守恒,理论上0.094mol的甲苯可以得到0.094mol的硝基甲苯,质量为0.094mol×137g/mol=12.9g,因产率为10%,实际硝基甲苯的质量为12.9g×
10%=1.3g,故答案为:1.3g.
点评 本题主要考查一硝基甲苯的制备,涉及实验流程、产率的计算等知识,明确物质的制备原理即流程的意义与目的为解答此类题的关键,充分考查了学生灵活应用所学知识的能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移电子为1.0mol | B. | W可能等于48.8 | ||
| C. | V可能等于360 | D. | 发生的反应均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$
+CH3COCHCOOC2H5$→_{10℃搅拌12h}^{浓H_{2}SO_{4}}$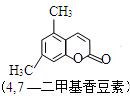

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )的说法中正确的是( )
)的说法中正确的是( )| A. | 分子组成符合通式CnH2n+2 | |
| B. | 分子中含有3个C-C键和3个C=C键 | |
| C. | 在空气中燃烧时产生较多的黑烟 | |
| D. | 苯中加入溴水后溴水层颜色变浅,这是发生了加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com