
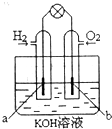
 某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
某课外活动小组进行电解饱和食盐水的实验.请同答下列问题.
| ||
| ||


科目:高中化学 来源: 题型:
| A、利用太阳能将海水蒸馏得到淡水,使太阳能转化成了化学能 |
| B、煤的气化就是将煤转化为可燃性气态的过程,是化学变化 |
| C、淀粉、蛋白质和油脂都是高聚物,在一定条件下都能水解 |
| D、石油裂解可以得到更多的汽油,这种汽油是一种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用电解熔融氯化钠的方法制取钠 |
| B、钠加入氯化镁的饱和溶液中可以制取金属镁 |
| C、电解冶炼铝的原料是氯化铝 |
| D、电解氯化镁溶液来制取镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 4.53g硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定400℃时剩余固体成分的化学式(写出计算过程).
4.53g硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请通过计算确定400℃时剩余固体成分的化学式(写出计算过程).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn、Fe |
| B、Zn、Ag |
| C、Al、Cu |
| D、Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.3g |
| B、25.4g |
| C、28.6g |
| D、50.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com