
| A. | 油条的制作口诀是“一碱、二矾、三钱盐”,其中的“碱”是烧碱 | |
| B. | 黑火药的最优化配方是“一硫二硝三木炭”,其中的“硝”是硝酸钾 | |
| C. | 过滤操作要领是“一贴二低三靠”,其中“贴”是指滤纸紧贴漏斗的内壁 | |
| D. | “固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖“.前一个固体一般指粉末状固体 |
分析 A、油条的制作口诀是“一碱、二矾、三钱盐”,“碱”指Na2CO3“矾”指明矾〔KAl(SO4)2•12H2O〕“盐”指NaCl;
B、黑火药的最优化配方是硫磺、硝石、碳;
C、一贴:用少量水润湿的滤纸要紧贴漏斗壁,二低:滤纸边缘低于漏斗边缘、滤液低于滤纸边缘,三靠:烧杯紧靠玻璃棒、玻璃棒靠在三层滤纸上、漏斗下端口紧靠烧杯内壁;
D、固体粉末药品放入试管中,采用药匙或纸槽,但是固体块状、大颗粒状需要用镊子.
解答 解:A、油条的制作口诀是“一碱、二矾、三钱盐”,“碱”指Na2CO3,不是NaOH,故A错误;
B、黑火药的最优化配方是硫磺、硝石、碳,即“一硫二硝三木炭”,其中的“硝”是硝酸钾,故B正确;
C、过滤操作要领是“一贴二低三靠”,一贴:用少量水润湿的滤纸要紧贴漏斗壁,二低:滤纸边缘低于漏斗边缘、滤液低于滤纸边缘,三靠:烧杯紧靠玻璃棒、玻璃棒靠在三层滤纸上、漏斗下端口紧靠烧杯内壁,故C正确;
D、固体粉末药品放入试管中,采用药匙或纸槽,但是固体块状、大颗粒状需要用镊子,即前一个固体一般指粉末状固体,故D正确.
故选A.
点评 本题考查学生化学知识的归纳和梳理、记忆等方面的知识,注意体会在社会、生产、生活中起着重要的作用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ① | C. | ④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)减小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中由水电离出的c(H+)=1×10-3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | 常温下,等物质的量浓度的三种溶液①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2)中c(NH4+):①<③<② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
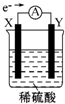 如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 外电路的电流方向为X→外电路→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X<Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | SO42-向X电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过溴水除去甲烷中的乙炔 | |
| B. | 将乙醇加热到170℃制备乙烯 | |
| C. | 加入浓溴水后过滤除去苯中的苯酚 | |
| D. | 加入氢氧化钠后蒸馏除去乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com