
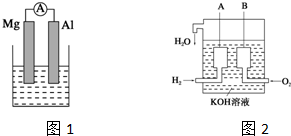
分析 (1)若烧杯中溶液为稀硫酸,该装置符合原电池构成条件,所以能构成原电池,则电流表指针发生偏转,Mg易失电子作负极、Al作正极;
(2)氢气、氧气和氢氧化钾溶液构成了原电池,自发的氧化还原反应是氢气和氧气之间的反应,总反应方程式为:2H2+O2=2H2O,负极上通的是氢气,发生氧化反应,装置中通入的H2改成甲烷(CH4),燃料电池的总反应离子方程式为:CH4+2O2+2OH-=CO32-+3H2O,正极上通的是氧气,电极反应:2O2+4H2O+8e-=8OH-,负的极一定是燃料失电子的过程,因正极和负极相加即为总反应,所以:CH4+8e-+10OH-=CO32-+7H2O.
解答 解:(1)若烧杯中溶液为稀硫酸,该装置符合原电池构成条件,所以能构成原电池,则电流表指针发生偏转,Mg易失电子作负极、Al作正极,负极反应式为Mg-2e-=Mg2+、正极反应式为2H++2e-=H2↑,所以看到的现象是:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转,故答案为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;
(2)氢气、氧气和氢氧化钾溶液构成了原电池,自发的氧化还原反应是氢气和氧气之间的反应,总反应方程式为:2H2+O2=2H2O,负极上通的是氢气,发生氧化反应,装置中通入的H2改成甲烷(CH4),燃料电池的总反应离子方程式为:CH4+2O2+2OH-=CO32-+3H2O,正极上通的是氧气,电极反应:2O2+4H2O+8e-=8OH-,负的极一定是燃料失电子的过程,因正极和负极相加即为总反应,所以:CH4+8e-+10OH-=CO32-+7H2O,
故答案为:氧化;CH4+8e-+10OH-=CO32-+7H2O.
点评 本题考查原电池工作原理知识,可以根据所学知识进行回答,难度不大.需要注意的握以镁、铝为电极材料,稀硫酸作电解质溶液,镁是负极,氢氧化钠作电解质,铝是负极.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 原子半径:Br>Cl>F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素和非金属元素交界处最容易找到制催化剂的材料 | |
| B. | 电能是现代社会中应用最广泛、最方便的一次能源 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 煤块粉碎为煤粉的目的是提高煤的燃烧效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3 | B. | Cu2(OH)2CO3 | C. | Ca(HCO3)2 | D. | NH4NO3 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
证明溴乙烷与NaOH醇溶液共热发生的是消去反应,分别设计甲、乙、丙三个实验:(甲)向反应混合液中滴入溴水,溶液颜色很快褪去.(乙)向反应混合液中滴入过量稀硝酸,再滴入AgNO3溶液,有浅黄色沉淀生成.(丙)向反应混合液中滴入酸性KMnO4溶液,溶液颜色褪去.则上述实验可以达到目的是( )
A.甲 B.乙 C.丙 D.都不行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com