
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?F-(aq)+H+(aq)△H=+10.4 kJ•mol-1 | |
| B. | NaF水解时的热化学方程式为F-(aq)+H2O(aq)=HF(aq)+OH-(aq)△H=+67.7KJ•mol | |
| C. | 溶液温度升高后,一定能促进弱电解质的电离 | |
| D. | 将含有0.1molHF与0.1molNaOH的两种物质混合后放出的热量为6.77KJ |
分析 A、利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B、反应热的单位是kJ•mol-1;
C、弱电解质的电离吸热;
D、两种物质的状态不知.
解答 解:A、利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,故A错误;
B、反应热的单位是kJ•mol-1,所以NaF水解时的热化学方程式为F-(aq)+H2O(aq)=HF(aq)+OH-(aq)△H=+67.7KJ•mol-1,故B错误;
C、电离吸热,升温能够促进弱电解质的电离,故C正确;
D、两种物质的状态不知,如氢氧化钠固体溶于水要放热,所以热效应要发生改变,故D错误;
故选C.
点评 本题考查了热化学方程式书写和盖斯定律应用,中和热概念实质理解应用,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 172.5 kJ/mol | B. | -172.5 kJ/mol | C. | 393.5 kJ/mol | D. | -393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
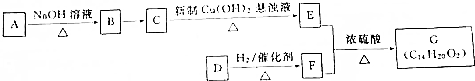
 或
或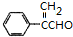 .
.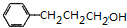 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$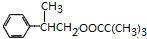 +H2O或(CH3)3CCOOH+
+H2O或(CH3)3CCOOH+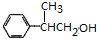 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$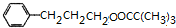 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14CO2的结构式为O═14C═O | B. | 14CO2和12CO2互为同分异构体 | ||
| C. | 14C和12C互为同素异形体 | D. | 14CO2和Na218O2反应生成15O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝与盐酸反应:2Al(OH)3+6H+═2Al3++6H20 | |
| C. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 偏铝酸钠溶液与适量稀硝酸反应:AlO2-+H++H20═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ/mol) | 390 | 190 | 946 | 460 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com