
 2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。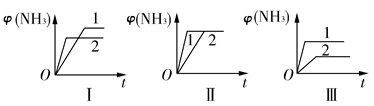
| A.图Ⅰ可能是不同压强对反应的影响,且p2>p1 |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2 |
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:不详 题型:单选题
 Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )
Z(g) ΔH<0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )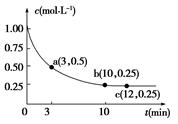
| A.a点正反应速率大于逆反应速率 |
| B.增大X的浓度,X的转化率增大 |
| C.容器中压强恒定时,不能说明反应已达平衡状态 |
| D.保持温度和密闭容器的容积不变,再充入1 mol X和2 mol Y,再次达到平衡时n(Z)/n(X)的值会变小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2XY3(g) ΔH=-92.6 kJ·mol-1
2XY3(g) ΔH=-92.6 kJ·mol-1| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热:23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。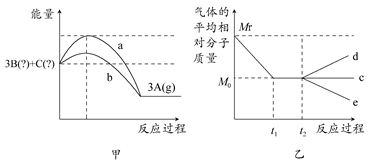
 3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡。下列说法中正确的是( )
A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡。下列说法中正确的是( )| A.平衡时C的转化率:乙>甲 |
| B.平衡时C的体积分数:乙>甲 |
| C.反应速率:乙>甲 |
| D.平衡时A的物质的量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O(g)的平衡常数随温度变化如下表:
CO(g)+H2O(g)的平衡常数随温度变化如下表:| t/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| | A | B | C | D | E |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
| 时间 /min | CO2 (mol·L-1) | H2 (mol·L-1) | CO (mol·L-1) | H2O (mol·L-1) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )
4C(g),达到化学平衡时测得c(A)=0.2 mol·L-1;压缩容器使压强增大到2.02×106 Pa,第二次达到平衡时,测得c(A)=0.36 mol·L-1;若继续压缩容器,使压强增大到5.05×106 Pa,第三次达到平衡时,测得c(A)=1.1 mol·L-1。则下列有关说法不正确的是 ( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 (H2O)x(g),反应物和生成物的物质的量随时间变化关系如图。下列说法不正确的是
(H2O)x(g),反应物和生成物的物质的量随时间变化关系如图。下列说法不正确的是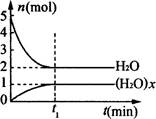
| A.x=3 |
| B.该温度下,反应的平衡常数为0.125L3/mol3 |
| C.平衡时混合气体的平均摩尔质量是33.3g/mol |
| D.t1时刻,保持温度不变,再充入1mol H2O(g),重新达到平衡时,c[(H2O)x]/c[H2O]增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com