
������,��ijһԪ��HA(�ס��ҡ�������������ͬ��һԪ��)��NaOH��Һ��������,������Һ�����ʵ���Ũ�Ⱥͻ����Һ��pH�����ʾ:
ʵ���� | HA�����ʵ� ��Ũ��(mol��L-1) | NaOH�����ʵ� ��Ũ��(mol��L-1) | ��Ϻ��� Һ��pH |
�� | 0.1 | 0.1 | pH=a |
�� | 0.12 | 0.1 | pH=7 |
�� | 0.2 | 0.1 | pH>7 |
�� | 0.1 | 0.1 | pH=10 |
(1)�Ӽ����������,����ж�HA��ǿ�ỹ������?
(2)��������Һ������Ũ��c(A-)��c(Na+)�Ĵ�С��ϵ�������� ����
A.ǰ�ߴ� B.���ߴ� C.�������D.���ж�
(3)�ӱ���ʵ��������,�û����Һ������Ũ���ɴ�С��˳������ ��
(4)��������ʵ������,д���û����Һ��������ʽ�ľ�ȷ���(��ʽ):
c(Na+)-c(A-)=����������������mol��L-1��
(1)a=7ʱ,HA��ǿ��;a>7ʱ,HA������
(2)C
(3)c(Na+)>c(A-)>c(OH-)>c(H+)
(4)(10-4-10-10)
��������(1)һԪ��HA��NaOH�����ʵ�����Ӧ,����ǿ��ȡ������ȫ�кͺ�����Һ��pH,a=7ʱΪǿ��,a>7ʱΪ����;(2)�ݵ���غ�,��c(Na+)+c(H+)=c(A-)+c(OH-),��c(H+)=c(OH-),����c(Na+)=c(A-);(3)��Ϊ��Ũ�ȵ�HA��NaA�Ļ����Һ,��pH>7֪A-ˮ��̶ȴ���HA�ĵ���,����Ũ�ȴ�С��ϵΪc(Na+)>c(A-)>c(OH-)>c(H+);(4)�ݵ���غ�c(Na+)+c(H+)=c(A-)+c(OH-),�Ƶ�c(Na+)-c(A-)=c(OH-)-c(H+)=10-4 mol/L-10-10 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��17�����仯������ϰ���������棩 ���ͣ�ѡ����
������ͼ��ʾװ����ȡ���������ռ���������(����)
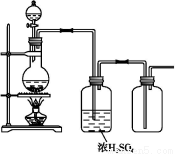
A.п��ϡ���ᷴӦ������
B.Ũ��ˮ���������ƹ��巴Ӧ�ư���
C.�������ƹ��������ᷴӦ�ƶ�������
D.ͭ��ϡ���ᷴӦ��һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��13����ͭ������Ҫ��������ϰ���������棩 ���ͣ�ѡ����
ij��ѧС���ڳ����²ⶨһ��������ijͭ���������ͭ����������,���������ʵ�鷽��:
������:ͭ������� �ⶨ������������
�ⶨ������������
������:ͭ������� �ⶨʣ����������
�ⶨʣ����������
�����й��ж��в���ȷ����(����)
A.��ҺA��B�������������NaOH��Һ
B.��ҺA��B������ѡ��ϡ����
C.����ҺBѡ��Ũ����,����ͭ����������ƫС
D.ʵ���ҷ����������ʵʩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��11�绯ѧ��ϰ���������棩 ���ͣ������
���ó���������ˮ��ϴ���ú�,���ֺ���ɫ�����,ijͬѧ�����ԭ�����������з���:
��1����ͬѧ��������ʵ����Ʒ:20% NaCl��Һ������ˮ����̪��Һ��KSCN��Һ��������ˮ������˿��̼����U�ιܡ����ߵ�;����������һ��ʵ�鷽������֤����������ʴ�ĵ缫����,�����������̲�д����Һ���йط�Ӧ�����ӷ���ʽ��
��2����һͭ����̼���õ������Ӻ�,������ʢ20%�Ȼ�����Һ��U�ι���,����ݴ�װ����������������һ
�ش�:
��������ԭ���,��˵��ԭ��:����������������������(����ش����,����Ģڲ��ûش�)��
������ԭ���,��Ҫ�����ô�װ��(�缫���ϡ���ҺŨ�Ⱦ�����),��ȡ�ʵ��Ĵ�ʩ����ߵ�صķŵ�Ч��,�ò���������:�� ��
��3��Ŀǰ�ҹ��������ͭ������¶����ø�ʴ����,�ڲ�Ӱ���հЧ����������,���üӱ����㷨������,���������һ�����Ч�ı��������������䱣��ԭ��: ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��11�绯ѧ��ϰ���������棩 ���ͣ�ѡ����
1 L K2SO4��CuSO4�Ļ����Һ��c(S )=2.0 mol��L-1,��ʯī�缫������Һ,��ͨ��һ��ʱ���,�������ռ���22.4 L(��״��)����,��ԭ��Һ��c(K+)Ϊ�� ��
)=2.0 mol��L-1,��ʯī�缫������Һ,��ͨ��һ��ʱ���,�������ռ���22.4 L(��״��)����,��ԭ��Һ��c(K+)Ϊ�� ��
A.2.0 mol��L-1 B.1.5 mol��L-1
C.1.0 mol��L-1 D.0.5 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��10����ˮ��������ܽ�ƽ����ϰ���������棩 ���ͣ�ѡ����
�±����������ε��ܶȻ�����(25 ��):
��ѧʽ | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
�ܶȻ� | 1.8��10-10 | 1.4��10-5 | 6.3��10-50 | 7.7��10-13 | 8.51��10-16 |
����˵������ȷ����(����)
A.���������ڳ�����Ag2SO4������Һ��c(Ag+)���
B.���Ȼ����ܽ���ˮ��,�����м���Na2S,��������ɺ�ɫ����
C.�����Ȼ������廯���͵⻯�����������ڳ����µı�����Һ��c(Ag+)�����ȡ��塢���˳������
D.�����ܽ�ƽ��Ľ�������������,��������ı�ʱ,ƽ��Ҳ�ᷢ���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ��ʦ֪ʶ�㾫�� ר��10����ˮ��������ܽ�ƽ����ϰ���������棩 ���ͣ�ѡ����
����FeCl3ˮ��Һ���ټ�ǿ��,�õ��Ĺ���������Ҫ��(����)
A.FeCl3 B.FeCl3��6H2O C.Fe(OH)3 D.Fe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ���ָ�ϰ��ʱ��ѵ ר��9�绯ѧԭ����ϰ��A�������棩 ���ͣ�ѡ����
��ѧ����������һ������ʽ�����������أ�����ʱ���տ����е������ڶ���Ƴɵ����������Ϸ�Ӧ���ܷ�Ӧ�ɱ�ʾΪ2Li��O2 Li2O2�������й�˵����ȷ���ǣ�������
Li2O2�������й�˵����ȷ���ǣ�������
A�����ʱ������Ƴɵĵ缫��ӵ�Դ����
B���ŵ�ʱ�����տ�����22.4 L��O2������2 mol e���ӵ�ظ�������
C���ŵ�ʱ��Li���Ӹ����������ƶ�
D���õ�ؿ�ʹ�ú�Li����ˮ��Һ���������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ���ָ�ϰ��ʱ��ѵ ר��7��ѧ��Ӧ���ʺͻ�ѧƽ����ϰ��A�������棩 ���ͣ�ѡ����
���Ĵ�����������Ҫ������������Ӧ��
(��)4NH3(g)��5O2(g) 4NO(g)��6H2O(g)����H����905.5 kJ��mol��1
4NO(g)��6H2O(g)����H����905.5 kJ��mol��1
(��)4NH3(g)��3O2(g) 2N2(g)��6H2O(g)����H����1267 kJ��mol��1
2N2(g)��6H2O(g)����H����1267 kJ��mol��1
����¶ȶ�NO��N2���ʵ�Ӱ����ͼ��ʾ������˵���������(����)
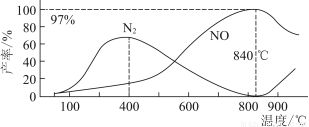
A�������¶ȣ���Ӧ(��)��(��)��ƽ�ⳣ������С
B��840 ���������¶ȣ���Ӧ(��)������Ӧ���ʼ�С����Ӧ(��)������Ӧ��������
C��900 ����NO�����½�����Ҫԭ���Ƿ�Ӧ(��)ƽ�������ƶ�
D��800 ������ʱ�����Ĵ�������Ҫ����(��)����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com