
短周期元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是其电子层数的3倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族。下列说法正确的是
A.单质的还原性:Y>Z
B.原子半径:Y<Z<W
C.气态氢化物的稳定性:X<W
D.Y和Z的最高价氧化物对应的水化物能相互反应
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、神舟10号飞船所用太阳能电池板的材料是单晶硅 | B、用于制作集成电路板的酚醛树脂是天然高分子化合物 | C、工业上获得大量乙烯、丙烯、丁二烯的方法是石油裂化 | D、日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
物 质 | CH4 | CO2 | CO | H2 |
平衡浓度(mol·L-1) | 0.5 | 0.5 | 2.0 | 2.0 |
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______ kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4  CH3COOH, 请回答:
CH3COOH, 请回答:
① 温度与催化剂的催化效率和乙酸的生成速率如图。

250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。
② 为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
③ Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
② Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 稀盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(16分)目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方。“达菲”的主要合成原料是我国盛产的莽草酸。从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒。下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构)。
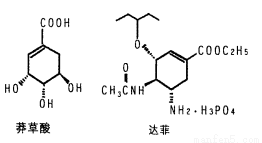
(1)“达菲”的相对分子质量为410.4,扣除H3PO4后的部分称为“自由基奥司他韦”。试求“自由基奥司他韦”的相对分子质量________;“自由基奥司他韦”能与磷酸结合,说明氨基具有________性。
(2)莽草酸中含有的官能团有__________________________(写名称)。
(3)下列有关莽草酸的说法中正确的是____________________________。
①分子式为C7H10O5
②能使FeCl3溶液显紫色
③能使溴的四氯化碳溶液褪色
④l mol莽草酸与分别足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为4:l
(4)莽草酸与C2H5OH发生酯化反应的化学方程式是_________________。
(5)莽草酸在浓硫酸作用下加热可得到B(C7H6O3),B的同分异构体中既含有酚羟基又含有酯基的共有______种,写出其中一种同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:实验题
(16分)白钨矿的主要成分是CaWO4 ,含有二氧化硅、氧化铁等杂质,工业生产钨流程如下:

(完全沉淀离子的pH值:SiO32-为8,WO42-为5)
(1)白钨矿反应前需要进行粉碎,其目的是____________。CaWO4与纯碱发生的化学反应方程式是_______________________________。
(2)滤渣A的主要成分是(写化学式)_____________,滤渣B的化学式是__________。
(3)调节pH可选用的试剂是:__________。
A.氨水 B.氢氧化钠溶液 C.盐酸
(4)母液中加入盐酸的离子方程式为________________________________________。
(5)白钨矿中CaWO4的质量分数为30%,576千克白钨矿理论上最多能生产钨_____kg。(已知钨酸钙的相对分子质量为288)
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,16 g O2含有nA个氧原子
B.1mol苯含有3nA个碳碳单键和3nA个碳碳双键
C.一定条件下,3molH2和1molN2充分反应后,可得到2nA个NH3分子数
D.1 mol·L-1 FeCl3溶液中含有Cl-总数为3nA
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:填空题
(11分)以食盐为原料进行生产并综合利用的某些过程如下图所示。
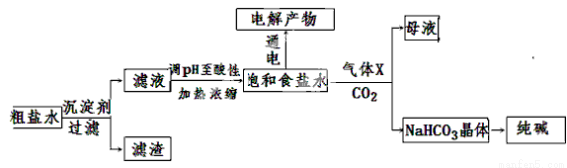
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填字母) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水可得到H2和另外两种产物,这两种物质相互反应的离子方程式为 ,欲从饱和食盐水中获得食盐晶体,可采用的实验方法是 。
(4)气体X可增大饱和食盐水吸收CO2的量,有利于NaHCO3晶体的生成和析出,X的化学式是 。
(5)下列有关NaHCO3和纯碱的说法正确的是 (填字母)
A.NaHCO3属于盐类,纯碱属于碱
B.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,产生气泡的速率相同
C.常温下在水中的溶解度,NaHCO3大于纯碱
D.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
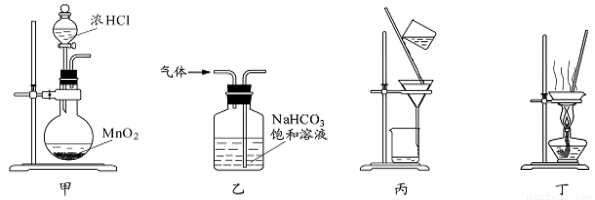
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制 MnCl2·4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com