
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 容器中有2HI(g)![]() H2(g)+I2(g),增大压强颜色变深
H2(g)+I2(g),增大压强颜色变深
【答案】C
【解析】
勒夏特列原理为如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应。
A、二氧化硫催化氧化是一个放热反应,升高温度平衡向逆反应方向移动;
B、催化剂只能改变反应速率,不影响平衡移动;
C、氯气和水反应生成盐酸和次氯酸的反应为可逆反应,增大氯离子浓度大,使平衡向逆反应方向移动;
D、增大压强,平衡不移动。
A项、二氧化硫催化氧化是一个放热反应,升高温度平衡向逆反应方向移动,但升高温度为加快反应速率,与平衡移动无关,故A错误;
B项、催化剂只能改变反应速率,不影响平衡移动,不能用勒夏特列原理解释,故B错误;
C项、氯化氢气体极易溶于水,而氯气和水反应生成盐酸和次氯酸的反应为可逆反应,氯化钠溶液中氯离子浓度大,使平衡向逆反应方向移动,减少氯气溶解度,用饱和食盐水除去氯气中氯化氢杂质能用勒夏特列原理解释,C正确;
D项、该反应是一个气态化学计量数不变的反应,增大压强,平衡不移动,不能用勒夏特列原理解释,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】石油是一种极其重要的化工原料,下图是石油加工的部分转化关系:
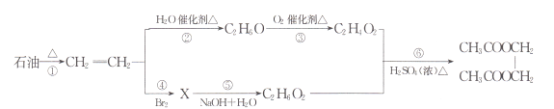
回答下列问题:
(l)石油化工生产中,通常将第①步转化的方法称为____;反应②的反应类型为____。
(2)反应③包含两步氧化反应,生成的C2H402属于酯类的同分异构体的名称为____,X的结构简式为____。
(3)一定条件下,乙烯能发生加聚反应,其化学方程式为____;反应⑥的化学方程式为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、 向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色。
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O_____________。
(2)只比较上述反应②与③,则判断I2起到了___________的作用。
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:___________(填化学式)。
II、一定条件下,向含硝酸的废水中加入CH3OH(碳元素为-2价),将HNO3还原成N2。若参加反应的还原剂和氧化剂的物质的量之比是5∶6,则该反应中被氧化的元素的化合价为_____;每转移3 mol电子,反应消耗_____g CH3OH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为_____________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ΔH>0,请你分析该设想能否实现并说明理由是____________________________________________。
(3)甲酸的电离平衡常数Ka=1.70×10-4。向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为______________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
(5)工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_______________________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
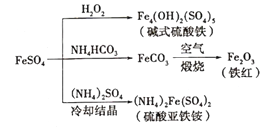
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列反应原理的离子方程式正确的是
A. 用加热的方法降低自来水中钙离子浓度:Ca2++2HCO3-![]() CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
B. 向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH-→CH2BrCOO-+H2O
C. 向Mg(HCO3)2溶液中加入足量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+H2O
D. 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O(g)=2 H2(g)+O2(g) ΔH=+496kJ·mol-1 。断开1 mol H—H键、O=O键分别需要吸收436 kJ、498 kJ的热量,则断开1 molO—H键需要吸收的热量为( )
A. 462 kJB. 469 kJC. 362 kJD. 466.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗,其制备过程如图所示,下列叙述不合理的是
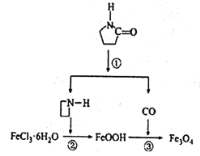
A. 在反应②中,![]() 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解
B. 直接加热FeCl3溶液也可以得到Fe3O4
C. 反应③的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D. 纳米四氧化三铁形成的分散系,有可能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:
A 金刚石与石墨;B 淀粉与纤维素;C 氕与氘;D 甲烷与戊烷; E 葡萄糖与果糖
F![]() 与
与 G
G  与
与
其中互为同位素 _____;(填编号.下同),互为同系物的是____,互为同分异构体的是______,是同一种物质的是________.
(2)化合物A的结构简式为: ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:_____;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为_____。
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:_____;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为_____。
(3)篮烷分子的键线式如图所示,试回答:

写出篮烷分子的化学式________;篮烷分子的一氯取代物的种数为______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com