
| A. | 气体甲一定是纯净物 | |
| B. | 白色沉淀乙不一定是Al(OH)3 | |
| C. | 固体X中一定存在 (NH4)2SO4、MgCl2、AlCl3 | |
| D. | 固体X中一定存在FeCl2、AlCl3 |
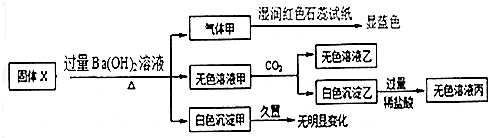
分析 固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,X中加入过量Ba(OH)2溶液并加热,产生气体甲,甲能使湿润的红色石蕊试纸变蓝色,说明甲中含有NH3,Al也能和NaOH反应生成氢气,所以甲可能是NH3也可能是H2和NH3,则X中一定含有(NH4)2SO4;产生白色沉淀甲,且沉淀甲久置没有明显变化,所以白色沉淀不是Fe(OH)2,则溶液中不存在FeCl2,生成的沉淀白色沉淀甲是BaSO4或BaSO4和Mg(OH)2的混合物,所以X中可能含有MgCl2;
无色溶液甲中通入二氧化碳生成白色沉淀乙和无色溶液乙,因为加入的Ba(OH)2是过量的,白色沉淀乙能溶于稀盐酸,所以生成的白色沉淀乙可能是BaCO3或Al(OH)3和BaCO3的混合物,则X中可能含有AlCl3;
据此分析解答.
解答 解:固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,X中加入过量Ba(OH)2溶液并加热,产生气体甲,甲能使湿润的红色石蕊试纸变蓝色,说明甲中含有NH3,Al也能和NaOH反应生成氢气,所以甲可能是NH3也可能是H2和NH3,则X中一定含有(NH4)2SO4;产生白色沉淀甲,且沉淀甲久置没有明显变化,所以白色沉淀不是Fe(OH)2,则溶液中不存在FeCl2,生成的沉淀白色沉淀甲是BaSO4或BaSO4和Mg(OH)2的混合物,所以X中可能含有MgCl2;无色溶液甲中通入二氧化碳生成白色沉淀乙和无色溶液乙,因为加入的Ba(OH)2是过量的,白色沉淀乙能溶于稀盐酸,所以生成的白色沉淀乙可能是BaCO3或Al(OH)3和BaCO3的混合物,则X中可能含有AlCl3;
A.通过以上分析知,气体甲可能是NH3也可能是H2和NH3,所以甲不一定是纯净物,故A错误;
B.通过以上分析知,白色固体乙可能是BaCO3或Al(OH)3和BaCO3的混合物,所以白色沉淀乙不一定是Al(OH)3,故B正确;
C.通过以上分析知,X中一定含有(NH4)2SO4,可能含有MgCl2、AlCl3,故C错误;
D.固体X中一定不存在FeCl2,可能含有AlCl3,故D错误;
故选B.
点评 本题考查物质检验和鉴别,为高频考点,明确物质性质及物质之间转化是解本题关键,熟练掌握物质之间的反应,侧重考查学生分析判断及思维缜密性,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 装置 | 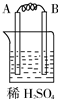 甲 甲 | 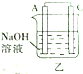 | 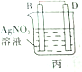 | 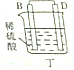 |
| 现象 | A不断溶解 | A极有气泡产生 | B电极质量增加 | B、D电极均无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
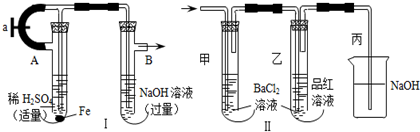
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸氢钠稀溶液 | B. | 硝酸钠溶液 | C. | 醋酸钠溶液 | D. | 硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为SiO2 | B. | 熔化时共价键断裂 | ||
| C. | 属于酸性氧化物 | D. | 1mol SiO2中含有4 mol Si-O键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com