
【题目】已知反应:
H2(g)+![]() O2(g)
O2(g)![]() H2O(g) △H1
H2O(g) △H1
![]() N2(g)+O2(g)
N2(g)+O2(g)![]() NO2(g) △H2
NO2(g) △H2
![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) △H3
NH3(g) △H3
则反应4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)的△H为( )
A.△H1+△H2+△H3B.2△H1+2△H2-2△H3
C.6△H1+4△H2+4△H3D.6△H1+4△H2-4△H3
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA、利用反应2MgO+Si![]() 2Mg↑+SiO2获取镁,每生成1mol Mg时,下列说法不正确的是
2Mg↑+SiO2获取镁,每生成1mol Mg时,下列说法不正确的是
A.消耗的MgO质量为40gB.断裂Si-Si键的数目为NA
C.转移的电子数为2NAD.生成镁蒸气体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和![]() 的混合物投入足量的
的混合物投入足量的![]() 中,收集到气体
中,收集到气体![]() 标准状况
标准状况![]() ,向反应后的溶液中
,向反应后的溶液中![]() 存在
存在![]() 和
和![]() 加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到
加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到![]() ,若上述气体为NO和
,若上述气体为NO和![]() 的混合物,且体积比为
的混合物,且体积比为![]() ,则V可能为
,则V可能为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业合成氨反应在生产中具有重要意义,完成下列问题:
(1)写出合成氨反应的热化学方程式:____。
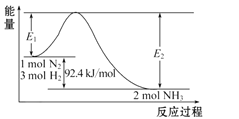
(2)在甲乙两个体积均为 2L 固定容积的密闭容器中,分别充入甲:1molN2、3molH2 和乙:2molN2、6molH2(其它条件相同),经过足够长的时间后,在乙容器中放出热量_____________ (填“大于”、 “小于”或“等于”)在甲容器中放出热量的 2 倍。
(3)下列图像分别代表焓变(△H)、混合气体平均相对分子质量(![]() )、N2 体积分数 φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是_____________ 。
)、N2 体积分数 φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是_____________ 。
A. 
B. 
C. 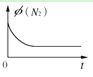
D. 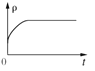
Ⅱ.常温下,有浓度均为 0.1 mol·L-1 的下列 4 种溶液:①H2SO4 溶液②CH3COOH 溶液③Na2CO3 溶液④NaOH 溶液
(1)以上 4 种溶液 pH 由大到小的排列顺序是______________(填序号),其中由水电离出的H+浓度最小的是____________ (填序号)。
(2)③溶液中离子浓度由大到小的顺序____________。
(3)该温度下向②中加入少量 CH3COONa,此时![]() 的值____________(填“增大”、“减小”或“不变”)。
的值____________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+2B(g) ![]() C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是( )
C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是( )
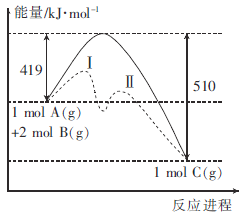
A.图中虚线表示加入了催化剂
B.图中虚线表示的反应I、反应II均为放热反应
C.加入催化剂,速率加快是因为改变了反应的焓变
D.该反应的焓变△H=-91kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NNO2(硝酰胺,Nitrarnide)是一种弱酸,常温下Ka1=10-5.6。常温下,硝酰胺分解反应,H2NNO2(aq)=N2O(g)+H2O(l)的第-步为O2NNH2(aq)![]() O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则
O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则![]() 等于( )
等于( )
A.5.6B.8.4C.-5.6D.-8.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存的基础。回答下列问题:
(1)下列不属于新能源的是___(填字母)。
a.煤炭 b.太阳能 c.风能 d.地热能 e.天然气 f.氢能
(2)甲烷裂解法制取乙炔反应的化学方程式为2CH4(g)![]() C2H2(g)+3H2(g)。
C2H2(g)+3H2(g)。
①已知下列化学键的键能数据:
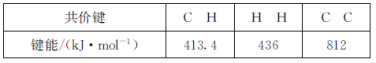
则反应2CH4(g)![]() C2H2(g)+3H2(g)的△H=___kJ·mol-1。
C2H2(g)+3H2(g)的△H=___kJ·mol-1。
②燃烧agCH4生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的CO2与足量澄清石灰水反应得到5g沉淀,则CH4(g)+2O2(g)![]() CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
CO2(g)+2H2O(l)△H1=___kJ·mol-1,a=___。
(3)金刚石和石墨为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时完全燃烧生成二氧化碳,反应中放出的热量如图所示。
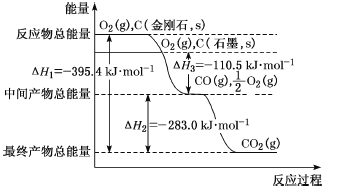
①在通常状况下,金刚石和石墨的稳定性较大的是___(填“金刚石”或“石墨”);石墨的燃烧热为___kJ·mol-1。
②12g石墨在-定量空气中燃烧,生成36g气体,该过程放出的热量为___kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如下图所示。下列说法正确的是
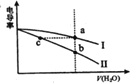
A. 曲线I表示NaoH溶液加水稀释过程中溶液电导率的变化
B. a、b、c三点溶液的pH: b>c>a
C. 将a、b两点溶液混合,所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
D. 醋酸溶液稀释过程中,c(CH3COO-)/c(CH3COOH)不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如下图所示。计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀。下列说法正确的是 ( )
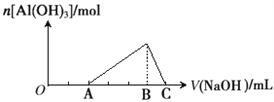
A. 原混合溶液中c(Fe3+):c(Al3+)=1:1
B. Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去
C. B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104
D. C点溶液中的溶质只有NaAlO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com