
| A. | 25℃时18 g水 | |
| B. | 标准状况下含6.02×1023个原子的Cl2 | |
| C. | 标准状况下1 mol氨气 | |
| D. | 常温常压下44 g二氧化碳 |
分析 A、水不是气体;
B、依据n=$\frac{N}{{N}_{A}}$计算;
C、标准状况气体摩尔体积为22.4L/mol;
D、依据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算.
解答 解:A、水不是气体,18g水时1mol,但体积不是22.4L,故A错误;
B、依据n=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{23}}{602×1{0}^{23}.}$=1mol,则氯气物质的量为0.5mol,标准状况体积为11.2L,故B错误;
C、标准状况气体摩尔体积为22.4L/mol,1mol氨体积等于22.4L,故C正确;
D、依据n=$\frac{m}{M}$=$\frac{44g}{44g/mol}$=1mol,n=$\frac{V}{{V}_{m}}$计算V,常温常压下气体摩尔体积大于标准状况下的气体摩尔体积22.4L/mol,1mol气体体积V大于22.4L,故D错误;
故选C.
点评 本题考查了气体摩尔体积的分析判断,主要是气体体积应用条件和概念理解,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:解答题
 .
.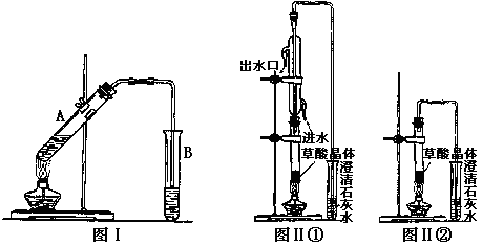
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
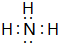 .
.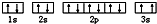 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2 HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O+CO32-═H2CO3+2 HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
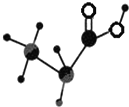 如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )
如图是某种有机物的简易球棍模型,该有机物中只含有C、H、O三种元素,下列关于该有机物的说法中正确的是( )| A. | 结构简式是C3H6O2 | B. | 不能和NaOH溶液反应 | ||
| C. | 官能团是羟基 | D. | 能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com