
分析 (1)Fe3+遇到KSCN溶液呈红色;
(2)Cu2O遇到酸产生Cu,Cu能与Fe3+反应;
(3)若固体全部溶解,则一定存在Fe2O3和Cu2O,根据物质的相关性质书写反应的有关离子方程式
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数.
解答 解:(1)若假设1成立,则溶液中含有Fe3+,遇到KSCN溶液呈红色,
故答案为:固体完全溶解,溶液呈血红色;
(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu能与Fe3+反应:2Fe3++Cu=2Fe2++Cu2+,则加入KSCN溶液也不变色,故此种说法不正确,
故答案为:不合理;当原粉末为Fe2O3和Cu2O的混合物时,加入稀硫酸后产生的Fe3+全部与Cu反应生成Fe2+,滴加KSCN溶液后也不变红色;
(3)固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,涉及反应的有关离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe2O3和Cu2O;
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数.
设样品中氧化亚铜的质量为m,
2Cu2O+O2═4CuO△m
288g 32g
m (b-a)g
m=$\frac{288(b-a)g}{32g}$=9(b-a)g,混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%,
故答案为:$\frac{9(b-a)}{a}$×100%.
点评 本题考查实验的设计及评价,以及物质的组成的测定,并涉及运用差量法进行计算,题目难度中等,做题时注意把握题给信息.


科目:高中化学 来源: 题型:选择题
| A. | 处于第5周期 | |
| B. | 质子数与中子数之差为50 | |
| C. | 原子的核外电子数是39 | |
| D. | ${\;}_{39}^{89}$Y和${\;}_{39}^{90}$Y是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
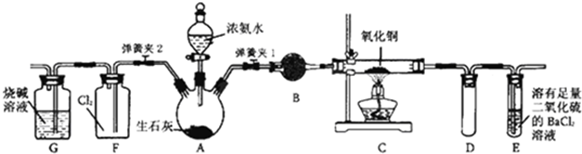
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2、FeCl3 | B. | NaHCO3、Na2CO3 | C. | NaAlO2、AlCl3 | D. | Mg(HCO3)2、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
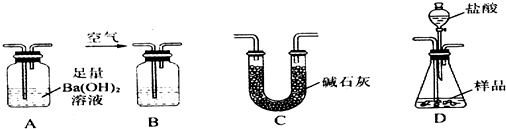
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
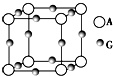 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤⑥ | C. | ①③④ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
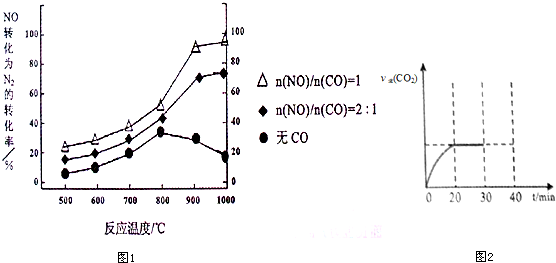
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
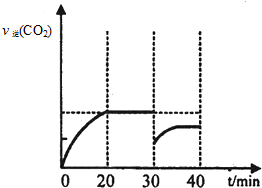 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
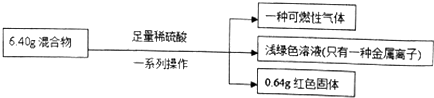
| A. | 原混合物中铜元素的质量一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com