
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是
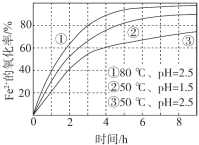
A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
【答案】D
【解析】
A、由②、③可知, pH越小,+2价铁氧化速率越快,故A错误;
B、若pH>7,FeCl2变成Fe(OH)2,Fe(OH)2非常容易被氧化成Fe(OH)3,故B错误;
C、由①、③推测,升高温度,相同时间内+2价铁的氧化率增大,升高温度+2价铁的氧化速率加快,由图中数据不能判断反应的热效应,故C错误;
D、50℃、pH=2.5时,4 h内Fe2+的氧化率是60%,即消耗0.6a mol/L,4 h内平均消耗速率等于0.15a mol/(L·h),温度升高到60℃、pH=2.5时,+2价铁的氧化率速率加快,4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)。
正确答案选D。


科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3![]() 2NaAlO2+CO;
2NaAlO2+CO;
完成下列填空:
(1)操作Ⅰ在常温下该反应速率极慢,下列措施中能使反应速率增大的是____。
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有___(填写化学式)。
(3)操作Ⅳ中有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、___、____、洗涤、干燥。
(4)如表是相关物质的溶解度数据,操作Ⅳ中发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,该反应在溶液中能发生的理由是____(文字说明)。
物质 | 溶解度(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取![]() 样品,加入过量____(填写试剂)、溶解、过滤、再加入(或通入)____(填写试剂)、……灼烧、冷却、称量,得干燥固体
样品,加入过量____(填写试剂)、溶解、过滤、再加入(或通入)____(填写试剂)、……灼烧、冷却、称量,得干燥固体![]() 。计算样品中氢氧化铝的质量分数为___(用含m、n的代数式表示)。
。计算样品中氢氧化铝的质量分数为___(用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种有机光电材料中间体。由A制备G的一种合成路线如下:
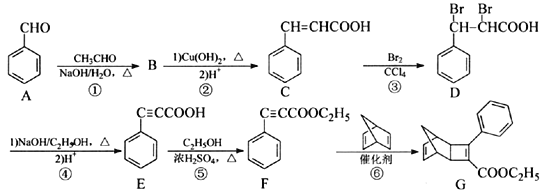
回答下列问题:
(1)F中的官能团名称为______。
(2)B的分子式为C9H8O,写出B的结构简式:______。
(3)反应②~⑥中属于取代反应的是______(填序号)。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:______。
Ⅰ.能发生银镜反应; Ⅱ.分子中含有苯环且有4种不同化学环境的氢。
(5)请写出以![]() 和CH3C≡CH为原料制备
和CH3C≡CH为原料制备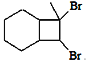 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
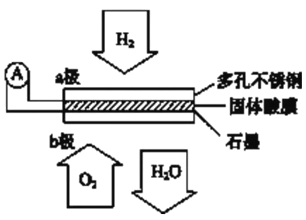
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e--=4OH--
C. 每转移0.1mol电子,消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平下列方程式,用双线桥法表示出电子转移的数目。 Fe2O3 + KNO3 + KOH = K2FeO4 + KNO2 + H2O ,____________,氧化剂 ________ ,氧化产物 __________
(2)用单线桥法表示下列氧化还原反应敀关系, 并标出电子转移的数目。用MnO2氧化密度为1.19 g/cm3,溶质质量分数为36.5%的HCl溶液,反应得到澄清溶液。反应的化学方程式为: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①该反应的离子方程式为: _____________________________________________,该盐酸的物质的量浓度为___________mol/L。
②氧化剂与还原剂物质的量之比为_______________
③8.7gMnO2与足量浓盐酸反应能使________molHCl被氧化;其中,还原过程为:________→_______,__________。
④如果该反应转移1mol电子,则生成标准状况下的气体体积为___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含Cl-、SO42-、CO32-、Cu2+、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液 100mL 进行以下实验:(填写下表空格)
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量NaOH溶液,得到蓝色沉淀; | 肯定有 Cu2+、肯定无__________。 | 肯定无该离子的理由_____。 |
步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到24.0g 固体; | Cu2+物质的量浓度为_____________mol/L | Cu 元素守恒。过滤所用玻璃仪器有烧杯、 ___________________ |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀。 | 肯定有Cl-、________; 肯定无Ba2+。 | 相应的离子方程式:___________________________ ,肯定有 Cl-的理由______________ |
若 100mL 溶液中含有 0.3mol Na+,则向步骤三的滤液中加入足量 AgNO3 溶液, 过滤、洗涤、干燥,可得到______________g 白色沉淀[保留小数点后一位]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g) ![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
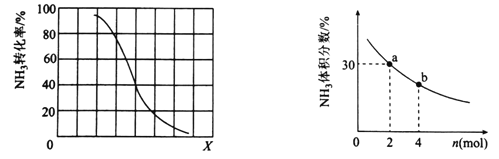
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
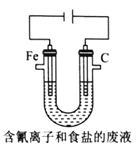
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
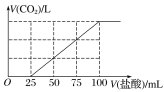
A. 原NaOH溶液的浓度为0.2 mol·L-1
B. 通入CO2在标准状况下的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请仔细观察以下2个装置,下列说法正确的是
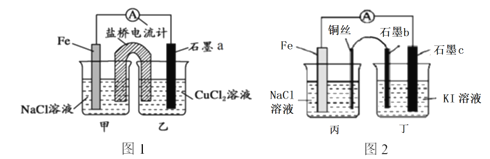
A. 图1石墨a为正极,图2石墨c也为正极
B. 图1是原电池装置,盐桥的作用是使电解质溶液始终保持电中性,以提供持续稳定的电流,图2装置不会产生电流
C. 图1石墨a电极上发生的反应为:O2+2H2O+4e-=4OH-
D. 图2石墨b上的产物能使淀粉溶液变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com