
 已知 X+、 Y2+、 Z-、 W2-四种离子均具有相同的电子层结构。下列关于 X、Y、Z、W 四种元素的描述,不正确的是
已知 X+、 Y2+、 Z-、 W2-四种离子均具有相同的电子层结构。下列关于 X、Y、Z、W 四种元素的描述,不正确的是
A.原子半径: X>Y>W>Z B.原子序数: Y>X>Z>W
C.原子最外层电子数: Y>X>Z>W D.金属性: X>Y ,还原性:W2->Z-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年新疆生产建设兵团二中高一下期中化学试卷(解析版) 题型:选择题
下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸反应 B.灼热的木炭与CO2反应
C.乙醇在氧气中燃烧 D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
在H2与Cl2生成HCl的反应中,已知断裂1 mol氢氢键吸收的能量为akJ,断裂1 mol氯氯键吸收的能量为bkJ,形成1 mol氢氯键放出的能量为ckJ,则生成1 molHCl放出的能量为( )
A.(c-a-b)kJ B.(a+b-c)kJ
C.(2c-a-b)kJ D.(2c-a-b)/2kJ
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省晋江市高一下学期期中考试化学试卷(解析版) 题型:填空题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。X是同周期中金属性最强的元素,五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位置是 。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: 。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ___,该物质所含有的微粒间作用力的类型为 。
(4)Z的氢化物与W的一种氢化物发生反应可生成Z的单质,写出其化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省晋江市高一下学期期中考试化学试卷(解析版) 题型:选择题
X、Y、Z是原子序数依次增大的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是( )
A.原子半径:Z>Y>X
B.Z与X形成的化合物的稳定性高于Z的其他同族元素与X形成的化合物的稳定性
C.Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省晋江市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.液氨汽化时要吸收大量的热,常用作制冷剂
B.压减燃煤、严格控车、调整产业是治理雾霾的有效措施
C.手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料
D.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸碱的腐蚀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省晋江市高二下学期期中考试化学试卷(解析版) 题型:实验题
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下
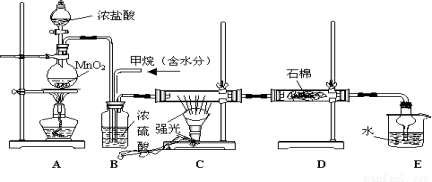
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应
(3)D装置的石棉中均匀混有KI粉末,其作用是 。
(4)E装置的作用是 (填编号)
A、吸收甲烷 B、吸收氯气 C、防止倒吸 D、吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(6)E装置除了生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。该装置还有缺陷,你认为是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省晋江市高二下学期期中考试化学试卷(解析版) 题型:选择题
苯环和侧链基相互影响,下列实验能说明甲苯中苯环对侧链有影响的是( )
A.甲苯能与浓硝酸、浓硫酸反应生成三硝基甲苯
B.甲苯能使酸性高锰酸钾溶液褪色
C.甲苯能燃烧产生带浓烟的火焰
D.1mol甲苯能与3molH 2发生加成反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省福州市五校高二下学期期中联考化学试卷(解析版) 题型:填空题
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为65,中子数为35.请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键.(2)X形成的单质与NaOH溶液反应的离子方程式为 ,超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体.
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答).
(4)Z的基态原子核外电子排布式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com