
| m |
| M |
| m |
| M |
| 2mω |
| 56 |
| mω |
| 28 |
| ||
| VL |
| mω |
| 28V |
| mω |
| 28V |
| x×1.84g/cm3×98% |
| 98g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 |
| B、电解质在水溶液和熔融状态下均能导电 |
| C、“PM2.5”是细小颗粒物悬浮在空气中形成胶体,严重危害人体健康 |
| D、“血液透析”利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=4 |
| B、每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol |
| C、将Y均匀分散到水中形成的体系具有丁达尔效应 |
| D、S4O62-是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数定 | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
| 时间/min | N2(mol?L-1) | 02(mol?L-1) | NO(mol?L-1) |
| 0 | 2.60 | 2.60 | 0 |
| 2 | 2.54 | 2.54 | 0.12 |
| 3 | c1 | c2 | c3 |
| 4 | c1 | c2 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
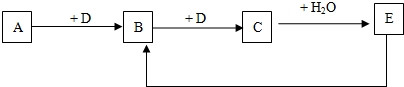
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:X>Y>Z>W |
| B、原子序数:Y>X>Z>W |
| C、原子最外层电子数:Y>X>Z>W |
| D、金属性:X<Y,还原性:W2->Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11% | B、28% |
| C、54% | D、9% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com