
【题目】2019年是门捷列夫发现元素周期律150周年。下表列出了①⑧八种元素在周期表中的位置:
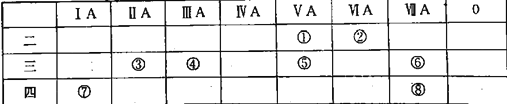
请按要求回答下列问题:
(1)写出元素②质量数为18的的核素符号_______。
(2)甲为③、⑥两元素组成的化合物,用电子式表示甲的形成过程__________。
(3)以上表中元素的最高价氧化物对应的水化物酸性最强的是_______。
(4)元素⑤的简单氢化物和元素①的简单氢化物与卤化氢的反应相似,产物的结构性质也相似。下列对元素⑤的简单氢化物与HI反应产物的推断正确的是_____(填序号)。
A.能与NaOH反应 B.含离子键、共价键 C.能与稀硫酸反应
(5)向元素⑦的单质与水反应后的溶液中加入元素④的单质,发生反应的离子反应方程式为_______。
(6)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出⑥形成的互化物和SO2在水溶液中发生反应的化学方程式_______。
【答案】![]()
![]() HClO4 AB 2Al+2OH-+2H2O=2AlO2-+3H2↑ BrCl+2H2O+SO2=H2SO4+HCl+HBr
HClO4 AB 2Al+2OH-+2H2O=2AlO2-+3H2↑ BrCl+2H2O+SO2=H2SO4+HCl+HBr
【解析】
先根据元素在周期表的位置确定各种元素,然后结合元素周期律及物质的原子结构、形成化合物时的特点、元素化合物的性质分析解答。
根据元素在周期表的位置可知各种元素分别是:①是N元素,②是O元素,③是Mg元素,④是Al元素,⑤是P元素,⑥是Cl元素,⑦是K元素,⑧是Br元素。
(1)②是O元素,质子数为8,质量数为18的O原子可表示为![]() ;
;
(2)Mg、Cl两种元素形成的化合物甲为MgCl2,该物质是离子化合物,用电子式表示为:![]() ;
;
(3)元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,在上述表格中,元素最高价氧化物对应的水化物的酸性最强的是HClO4;
(4)NH3与HCl反应形成NH4Cl,由于同一主族元素形成的化合物性质相似,所以P元素的氢化物PH3与HCl反应产生的物质PH4Cl结构与NH4Cl也相似,属于离子化合物,含有离子键、极性共价键,能与强碱NaOH发生反应,产生NaCl、PH3、H2O,而不能与酸反应,故合理选项是AB;
(5)K与水反应产生KOH和氢气,向该溶液中加入Al,会发生反应产生KAlO2、H2,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。如⑥形成的互化物BrCl性质类似Cl2,BrCl和SO2在水溶液中发生反应,产生HCl、HBr、H2SO4,反应的化学方程式为BrCl+2H2O+SO2=H2SO4+HCl+HBr。


 互动课堂系列答案
互动课堂系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
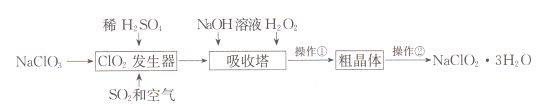
已知:①HC1O2可视为强酸,NaClO2的溶解度随温度升高而增大。②ClO2的沸点为283K,纯ClO2易分解爆炸。回答下列问题:
(1)ClO2发生器中发生反应的离子方程式为____;向其中鼓入空气的作用可能是____。
(2)吸收塔中发生反应的化学方程式为____;为防止生成的NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是____(填序号)。
A.Na2O2 B.Na2S C. FeCl2 D.KMnO4
(3)操作①的实验方法依次是_____、_____、过滤;操作②实验方法是_____。
(4)akg NaClO3理论上可制___ kg NaClO2·3H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是

A. 甲为C,X是O2
B. 甲为 Fe,X 为 Cl2
C. 甲为SO2,X是NaOH溶液
D. 甲为A1C13,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧的过程中会释放大量的SO2,严重破坏生态环境,采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放,但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率,相关反应的热化学方程式如下:CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJmol﹣1(反应Ⅰ),CaSO4(s)+4CO(g)CaS(s)+4CO2(g) △H2=﹣175.6kJmol﹣1(反应Ⅱ),假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将4molA和3molB充入体积为1L的密闭容器中,发生如下反应:aA(g)+2B(g)![]() 3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
3C(g)+D(g)。反应达到平衡后,C的浓度为3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池,电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1mol CH4,可以向外电路提供约![]()
![]() 的电量;
的电量;
②负极上CH4失去电子,电极反应式为: CH4-8e-+10OH—=CO32-+7H2O
③负极上是O2获得电子,电极反应式为![]() ;
;
④电池放电后,溶液pH不断升高
A.①②B.①③C.①④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是

A. 正极电极反应式为:2H++2e—→H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示:
(1)2个铜离子__________;
(2)氧化铁中铁元素的化合价为+3价_______;
(3)溶于水温度降低的一种盐_________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com