
| A. | 降低温度,可提高反应速率 | |
| B. | 加入合适的催化剂,可提高N2的转化率 | |
| C. | N2的正反应速率等于NH3的逆反应速率 | |
| D. | 反应物和生成物的浓度都不再发生变化 |
分析 A.降低温度,反应速率减小;
B.催化剂对平衡移动无影响;
C.平衡时不同物质的正逆反应速率之比等于化学计量数之比;
D.平衡时各组分的浓度不变.
解答 解:A.降低温度,反应速率减小,且该反应为放热反应,平衡正向移动,故A错误;
B.催化剂对平衡移动无影响,则不能提高转化率,故B错误;
C.平衡时不同物质的正逆反应速率之比等于化学计量数之比,则平衡时N2的正反应速率不等于NH3的逆反应速率,故C错误;
D.平衡时各组分的浓度不变,则平衡时反应物和生成物的浓度都不再发生变化,故D正确;
故选D.
点评 本题考查化学平衡,为高频考点,把握温度、浓度对平衡移动的影响、平衡判定为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
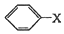 +CH2═CH-M$→_{碱}^{Pb}$
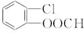
+CH2═CH-M$→_{碱}^{Pb}$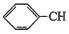 =CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
=CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: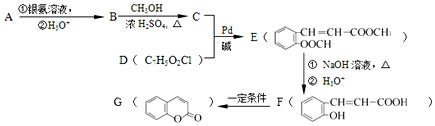
 .
.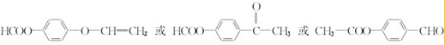 中任意2种.
中任意2种.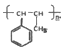 的路线流程图:
的路线流程图: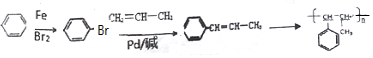 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1KClO3溶液中含有的氯离子数目为NA | |
| B. | 22.4LH2含有的分子数目为NA | |
| C. | 等质量的C2H2与C6H6含有的原子总数相等 | |
| D. | 1molZn变为Zn2+时失去的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA | |
| B. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| C. | 标准状况下,22.4 L氮气与22.4 L苯所含分子数均为 NA | |
| D. | 常温常压下,32gO2、O3的混合物含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
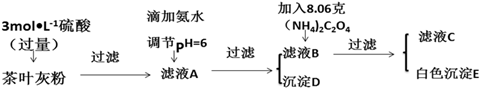
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g质量分数为98%的浓硫酸中所含有的氧原子数为4NA | |
| B. | 足量的Fe与6.72LCl2反应转移的电子数为0.6NA | |
| C. | 密闭容器中1molN2与4molH2反应生成的NH3分子数小于2NA | |
| D. | 3g乙烷含有共用电子对为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com