
【题目】已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s) +1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s) +O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,
回答下列问题:
(1)上述反应中属于放热反应的是____________。
(2)H2的燃烧热为________________;C的燃烧热为________________。
(3)燃烧10 g H2生成液态水,放出的热量为________________。
(4)写出CO燃烧的热化学方程式__________________________________。
【答案】①②③④ 285.8 kJ·mol-1 393.5 kJ·mol-1 1429 kJ CO(g)+![]() O2(g)=CO2(g) ΔH=-283kJ·mol-1
O2(g)=CO2(g) ΔH=-283kJ·mol-1
【解析】
(1)放热反应焓变小于零,吸热反应焓变大于零;
(2)在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热;
(3)依据热化学方程式①计算;
(4)在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,结合盖斯定律解答。
(1)△H<0的反应属于放热反应;△H>0的反应属于吸热反应。根据给出的热化学方程式可知:①②③④四个反应的△H<0属于放热反应;故答案为:①②③④;
(2)根据燃烧热的定义知:H2燃烧时生成液态水更稳定,所以H2(g)+1/2O2(g)═H2O(l) △H=285.8kJ·mol1就是氢气的燃烧热表示的热化学方程式,其燃烧热△H=285.8kJ·mol1;C(s)+O2(g)═CO2(g)△H=393.5kJ·mol1,碳的燃烧热△H=393.5kJmol1。故答案为:285.8kJ·mol1;393.5kJ·mol1;
(3)设燃烧10 g H2生成液态水,放出的热量为x kJ。由热化学方程式①可知
H2(g)+1/2O2(g)═H2O(l) Q
2g 285.8kJ
10g x kJ
x=285.8×10/2=1429kJ
故答案为:1429kJ;
(4)CO燃烧热是1mol可燃物CO完全燃烧生成稳定氧化物二氧化碳放出的热量,CO(g)+1/2O2(g)═CO2(g)可以是④③得到,即CO(g)+1/2O2(g)═CO2(g) △H=(393.5kJ·mol1)(110.5kJ·mol1)=283.0kJ·mol1,即CO(g)+1/2O2(g)═CO2(g)△H=283.0kJ·mol1。故答案为:CO(g)+1/2O2(g)═CO2(g)△H=283kJ·mol1。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】有一瓶溶液只含Cl-、CO32—、SO42—、Na+、NH4+、K+、Mg2+七种离子中的某几种。经实验:
①原溶液![]() 白色沉淀;
白色沉淀;
②将①所得溶液![]() 放出使湿润的红色石蕊试纸变蓝的气体;
放出使湿润的红色石蕊试纸变蓝的气体;
③原溶液中加BaCl2溶液不产生沉淀。
④原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
回答下列问题:
(1) 试分析原溶液中一定含有的离子是________________,一定不含有的离子是____________,可能含有的离子是________________。
(2) 有同学认为实验④可以省略,你认为呢?(填“可以”或“不可以”)_________,并说明理由___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是
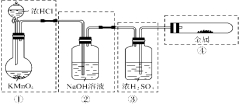
A.②和④处 B.只有②处 C.②和③处 D.②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:
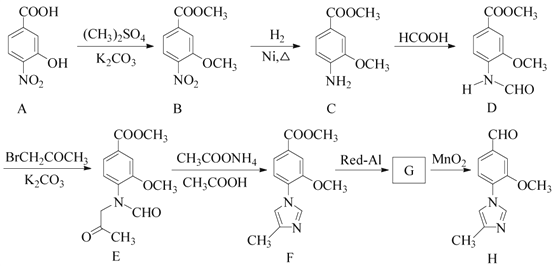
(1)C中的含氧官能团名称为_______和__________。
(2)D→E 的反应类型为__________________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:_____________________。 ①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2 ,经氧化得到H,写出G的结构简式:__________________。
(5)已知: ![]() (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) __________________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按照单质、化合物、混合物顺序排列的是( )
A.石墨 Fe(OH)3胶体 澄清石灰水
B.氮气 干冰 冰水混合物
C.硫粉 碘酒 含氧40%的氧化镁
D.液态氧 CuSO4·5H2O 浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)![]() pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
A. C的体积分数增加 B. A的转化率降低
C. 平衡向正反应方向移动 D. m+n>p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素z、e、g、h,在常温下其最高价氧化物对应水化物溶液(浓度均为0.01 mol·L-1)的pH与原子序数的关系如图所示。下列说法正确的是

A. 离子半径大小: e>g>h
B. g位于第三周期VA族
C. e2g2中既含有离子键又含有非极性共价键
D. 同浓度简单氢化物水溶液的pH值: h >g> z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 电解NaCl溶液、熔融态的氯化镁可制得相应的金属单质
B. 工业上可用含Cu2S的矿石和氧化剂O2反应冶炼Cu
C. 铝热反应可用于冶炼高熔点金属,如K、Ca、Cr、Mn等
D. 工业电解熔融态的Al2O3制Al时,加冰晶石的主要作用是提高Al的产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com