
| A. | 除去乙酸乙酯中少量的乙酸:加入少量乙醇,将其转化为乙酸乙酯 | |
| B. | 除去Fe(OH)3胶体中的NaCl:用水溶解后过滤 | |
| C. | 除去苯中的苯酚:加入浓溴水后过滤 | |
| D. | 除去溴乙烷中的溴:加入Na2S03溶液再分液 |
分析 A.乙酸与乙醇的反应为可逆反应;
B.二者都能透过滤纸;
C.溴以及三溴苯酚都溶于苯;
D.溴与亚硫酸钠反应,溴乙烷不溶于水.
解答 解:A.乙酸与乙醇的反应为可逆反应,不能完全除去杂质,可加入饱和碳酸钠溶液,故A错误;
B.二者都能透过滤纸,应用半透膜,用渗析的方法分离,故B错误;
C.苯酚与溴反应生成三溴苯酚,溴以及三溴苯酚都溶于苯,不能得到纯净的苯,应用氢氧化钠溶液除杂,故C错误;
D.溴与亚硫酸钠反应,溴乙烷不溶于水,可用于除杂,故D正确.
故选D.
点评 本题考查混合物分离提纯的方法和选择,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,注意有机物的性质及除杂的原则,题目难度不大.


科目:高中化学 来源: 题型:解答题
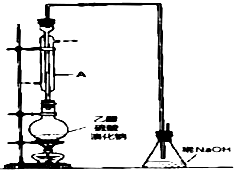 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
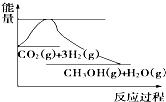 实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H>0,△S>0 | D. | △H<0,△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①③④⑥ | C. | ①③④⑤⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com