
【题目】苯乙烯是一种重要的有机化工原料,其结构简式为![]() ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )
A.难溶于水,易溶于有机溶剂,在空气中燃烧产生黑烟
B.分子中的所有原子一定在同一平面内
C.它能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色
D.能发生加成反应,在一定条件下最多可与四倍物质的量的氢气加成
【答案】B
【解析】
A. 苯乙烯属于烃类,难溶于水,易溶于有机溶剂,其分子式为C8H8,碳的含量较高,在空气中燃烧产生黑烟,A不符合题意;
B. 苯乙烯是一个苯基取代乙烯的一个氢,或一个乙烯基取代苯的一个氢形成的,乙烯所有原子共平面,苯的所有原子共平面,但由于乙烯和苯环相连接的是单键,它是可以任意旋转的,所以苯乙烯中所以原子可能在同一平面内,也可能不在同一平面内,B符合题意;
C. 含有碳碳双键,可与溴的四氯化碳溶液发生加成反应使之褪色,可被酸性高锰酸钾氧化使酸性高锰酸钾溶液褪色,C不符合题意;
D. 1mol 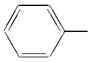 能与3mol H2发生加成反应,1mol
能与3mol H2发生加成反应,1mol 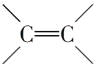 能与1mol H2发生加成反应,故与四倍物质的量的氢气发生加成反应,D不符合题意;
能与1mol H2发生加成反应,故与四倍物质的量的氢气发生加成反应,D不符合题意;
故答案为:B。


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
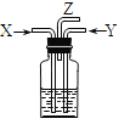
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中,一定相等的是
A.等物质的量的OH-和-OH中所含电子数
B.等质量的氧气和臭氧中含有的氧原子数目
C.1molNa2O2固体中阳离子与阴离子的数目
D.等物质的量的Cu与Fe分别与足量的稀硝酸反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,为无色晶体,是二元弱酸,其电离常数Ka1=5.4×10![]() ,Ka2=5.4×10
,Ka2=5.4×10![]() 。回答下列问题:
。回答下列问题:
(1)向10 mL0.1mol·L![]() H2C2O4溶液中逐滴加入0.1mol·L
H2C2O4溶液中逐滴加入0.1mol·L![]() NaOH溶液
NaOH溶液
①当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)___________10 mL(填“>”“=”或“<”)。
②随着苛性钠的加入,H+逐渐减少,当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________(填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
(2)某同学设计实验测定含杂质的草酸晶体(H2C2O4·2H2O)纯度(杂质不与酸性高锰酸钾反应)。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解,用c mol·L![]() KMnO4标准溶液进行滴定
KMnO4标准溶液进行滴定
①通常高锰酸钾需要酸化才能进行实验,通常用_________酸化
A.硫酸 B.盐酸 C.硝酸 D.石炭酸
②则达到滴定终点时的现象是_____________________;
③该过程中发生反应的离子方程式为___________________________;
④滴定过程中消耗V mL KMnO4标准溶液,草酸晶体纯度为_________________。
(3)医学研究表明,肾结石主要是由CaC2O4 组成的,已知Ksp(CaC2O4)=2.3×10-9,若血液经血小球过滤后,形成的尿液为200 mL,其中含有Ca2+ 0.01 g。为了不形成CaC2O4 沉淀,则C2O42-的最高浓度为______ mol·L![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知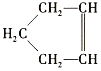 可简写为
可简写为![]() ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为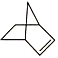 。
。
(1)降冰片烯属于(___________)(填序号)
A.环烃 B.不饱和烃 C.烷烃 D.芳香烃
(2)降冰片烯的分子式为__。
(3)降冰片烯不具有的性质是(___________)(填序号)
A.能溶于水 B.能发生氧化反应
C.能发生加成反应 D.常温常压下为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是 ( )

A. 迷迭香酸与溴单质只能发生取代反应
B. 1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应、消去反应和酯化反应
D. 1 mol迷迭香酸最多能和6 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
①________,②________,③________,④__________,⑤__________。
(2)图中现象c表明检验出的离子是________________。
(3)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(4)气体E通入试剂④发生反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与FeSO4反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 | C4H4O4 | 116 | K1=9.5×10-4,K2=4.2×10-5 |
碳酸 | H2CO3 | K1=4.4×10-7,K2=4.7×10-11 | |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100 mL烧杯A中,加热水搅拌
②加入Na2CO3溶液10 mL使溶液pH为6.5~6.7。并将上述溶液移至100 mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入FeSO4溶液30 mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量。
请回答以下问题:
(1)该实验涉及到的主要仪器需从以下各项选择,则B为_________(填字母),C为___________(填名称);

(2)己知反应容器中反应物FeSO4和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入Na2CO3溶液调节pH的目的是_____________,若加入Na2CO3溶液过量,对实验的影响是_____________;
(3)所需FeSO4溶液应现用现配,用FeSO4·7H2O固体配置FeSO4溶液的方法为:__________;
(4)写出容器B中制备富马酸亚铁的化学方程式:___________;
(5)步骤④检验沉淀是否洗净的方法是:________________;
ii. 计算产品的产率:
(6)经测定,产品中富马酸亚铁的纯度为76.5%、以5.80 g富马酸为原料反应制得产品8.50 g,则富马酸亚铁的产率为______________%(保留小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com