

分析 (1)Cu元素是29号元素,其原子核外有29个电子,Cu原子失去2个电子生成Cu2+,根据构造原理书写铜离子核外电子排布式;
(2)①根据图象知铜离子的配位数是4,另外一个水分子是结晶水分子;
②根据价层电子对互斥理论确定离子空间构型及原子杂化方式;根据等电子体概念可知,原子数和价电子数都相等的微粒互为等电子体,据此分析;氢化物都是分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的氢化物熔沸点较高;
(3)NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(4)该晶胞中黑色球个数=12×$\frac{1}{4}$=3,白色球个数=8×$\frac{1}{8}$=1,根据其化学式知,黑色球表示Cu+、白色球表示N3-,N3-的配位数为6;该晶胞的体积=a3cm3,密度b=$\frac{\frac{64×3+14}{N{\;}_{A}}}{a{\;}^{3}}$,据此计算NA.
解答 解:(1)Cu元素是29号元素,其原子核外有29个电子,Cu原子失去2个电子生成Cu2+,根据构造原理知铜离子核外电子排布式为[Ar]3d9,故答案为:[Ar]3d9;
(2)①根据图象知铜离子的配位数是4,另外一个水分子是结晶水分子,所以其表示式为[Cu(H2O)4]SO4•H2O,故答案为:[Cu(H2O)4]SO4•H2O;
②胆矾中SO42-的价层电子对个数=4+$\frac{1}{2}$×(6+2-4×2)=4,所以其空间构型正四面体结构,H2O中O原子价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=4且含有两个孤电子对,所以O原子的杂化方式为sp3;
根据等电子体概念可知,原子数和价电子数都相等的微粒互为等电子体,SO42-离子中有5个原子,价电子数为32,所以与SO42-离子互为等电子体的一种分子为CCl4、SiCl4等;氢化物都是分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的氢化物熔沸点较高,H2O分子中含有氢键,所以熔沸点最高,熔沸点高低顺序是H2O>H2Se>H2S,
故答案为:正四面体;CCl4;sp3;H2O>H2Se>H2S;
(3)F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子,所以NF3不易与Cu2+形成配离子,故答案为:F的电负性大于N元素,NF3中N-F成键电子对偏向于F原子,N原子上的孤对电子难与铜离子形成配离子;
(4)该晶胞中黑色球个数=12×$\frac{1}{4}$=3,白色球个数=8×$\frac{1}{8}$=1,根据其化学式知,黑色球表示Cu+、白色球表示N3-,N3-的配位数为6;该晶胞的体积=a3cm3,密度b=$\frac{\frac{64×3+14}{N{\;}_{A}}}{a{\;}^{3}}$,则NA=$\frac{64×3+14}{a{\;}^{3}b}$=$\frac{206}{a{\;}^{3}b}$,
故答案为:6;$\frac{206}{a{\;}^{3}b}$.
点评 本题考查了物质结构和性质,涉及原子核外电子排布式的书写、微粒空间构型及原子杂化方式的判断、晶胞的计算等知识点,这些知识点都是高考高频点,根据构造原理、价层电子对互斥理论、密度公式进行分析解答即可,难点是晶胞的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 人们最熟悉的液态金属是水银,因其价格太贵而限制了实际应用 | |
| B. | 液态金属中存在的粒子有金属阳离子和自由电子,它们之间通过静电作用形成离子键 | |
| C. | 铝在液态金属中燃烧放出热量从而提供能量,使液态金属实现高速、高效的长时运转 | |
| D. | 液态金属机器“吞食”铝片后,在电解质里形成原电池反应,会产生电力和气泡,从而产生动力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s内用物质A表示的平均反应速率为0.3mol•L-1•s-1 | |
| B. | 2s内用物质B表示的平均反应速率为0.6 mol•L-1•s-1 | |
| C. | 2s后每有0.6 mol的物质B生成,同时就有0.6 mol物质C生成 | |
| D. | 2s时物质B的物质的量浓度为1.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
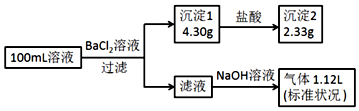
| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-和Na+ | |
| C. | 原溶液中c(Cl-)≥0.2mol•L-1 | |
| D. | 若原溶液中c(NH4+)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途.回答下列问题:
铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途.回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH | B. | CH≡C-CH3 | C. | CH2=CH-CH=CH2 | D. | CH2=C(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com