
����Ŀ���ߴ���ˮ�Ȼ��Ⱦ���(SrCl2��6H2O)�����л��ϳɵĴ�������̼���ȿ�ʯ(������BaCO3��FeO��SiO2������)�Ʊ��ߴ���ˮ�Ȼ��Ⱦ���Ĺ�����ͼ��ʾ��
��֪��

I��25�棬Ksp[Fe(OH)3]=1��0��10-38 ��Ksp[Fe(OH)2]=1��0��10-16
��SrCl2��6H2O������61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��
��ش�
(1)������н���ʯ�Ƴɽ�Һ�ܼӿ췴Ӧ���ʵ�ԭ����_____________________________��
(2)�ڡ���Һ���м��빤ҵ���ᣬ����ȵĽ��������¶ȡ�ʱ��Ĺ�ϵ��ͼ��ʾ��

�ݴ˺��ʵĹ�ҵ��������Ϊ_________________________��
(3)����ڡ���Һ���м���30����H2O2����������_____________________________(�����ӷ���ʽ��ʾ)��
(4)�����������������Ҫ�ɷֳ�Fe(OH)3�⣬����_______________________(�ѧʽ)��25�棬ΪʹFe3+������ȫ�������ҺpHֵ��СΪ_____________(������Ũ�ȼ�С��1��0��10-5mol��L-1ʱ������Ϊ������ȫ)��
(5)�������������и������˵������ȷ����___________(����)��
A���������60�����ˮԡ�����������о�Ĥ����
B���������ȴ�ᾧ������Ӧͨ��HC1����
C������ݸ���SrCl2��6H2O������Բ��ü�ѹ����
(6)Ϊ�ⶨ����SrCl2��6H2O(Mr=267)������Ʒ�Ĵ��ȣ���������·�������ȡ1��10g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO31��70g��AgNO3��Һ(��Һ�г�Cl-�⣬����������Ag+��Ӧ���ɳ���������)��C1-����ȫ��������Ȼ���ú�Fe3+����Һ��ָʾ������0��100 mol��L-1��NH4SCN����Һ�ζ�ʣ���AgNO3��Һ��ʹʣ���Ag+��AgSCN��ɫ��������ʽ��������___________ʱ�ﵽ�ζ��յ㣬��ȥNH4SCN��Һ20��00 mL����ԭSrCl2��6H2O����Ĵ���Ϊ________________��(����������1λС��)��
���𰸡�����Ӧ��Ӵ���� 40![]() 2Fe2++H2O2+2H+=2Fe3++2H2O SiO2 ��BaSO4 3 AC ���һ��NH4SCN��Һ���룬��ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ 97.1
2Fe2++H2O2+2H+=2Fe3++2H2O SiO2 ��BaSO4 3 AC ���һ��NH4SCN��Һ���룬��ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ 97.1
��������
��1������Ӱ�컯ѧ��Ӧ���ʵ����أ�����Ӵ�������������¶ȡ�����������Ũ�ȡ����ֽ���ȶ��ܼӿ췴Ӧ���ʽ����жϣ���2������ͼ1��ͼ2�����жϣ���3����̼���ȿ�ʯ(������BaCO3��FeO��SiO2������)�������ˮ�ټӹ�ҵ�����FeO��������ʱ�����������ӣ�˫��ˮ����ǿ�����ԣ����Խ�������������Ϊ�����ӣ����Լ�30����H2O2��ϡ�������������ԭ��Ӧ����Fe2+����ΪFe3+��Ba2+��SO42-����BaSO4������ͨ������pH��ʹ��Һ�е�Fe3+���Fe(OH)3��������ȥ����4�������ܶȻ�������⣻��5�����������Ϣ�������𣻣�6������ʵ����̺�ϵʽ���н��
(1)����Ӱ�컯ѧ��Ӧ���ʵ����أ�����Ӵ�������������¶ȡ�����������Ũ�ȡ����ֽ���ȶ��ܼӿ췴Ӧ���ʡ�������н���ʯ�Ƴɽ�Һ������Ӧ��Ӵ�������ܼӿ췴Ӧ���ʣ��𰸣�����Ӧ��Ӵ������
(2)������Һ���м��빤ҵ���ᣬ�����ȵĽ��������¶ȡ�ʱ��Ĺ�ϵͼ��ͼ1��֪��40��ʱ�ȵĽ�������ߣ���ͼ2��֪60min�ȵĽ�������ߣ����Թ�ҵ�������ʵ�����Ϊ40�棻60min���𰸣�40�棻60min��
(3)���������������������Һ���к���Fe2+������30����H2O2��ϡ���ᣬ�ᷢ��2Fe2++H2O2+2H+=2Fe3++2H2O��H2O2���������������ã��𰸣�2Fe2++H2O2+2H+=2Fe3++2H2O��
(4)�����������������Ҫ�ɷֳ�Fe(OH)3�⣬���в�����ˮ�����SiO2���壬�����й��������ɵ�BaSO4������25�棬Ksp[Fe(OH)3]=1.0��10-38 ��ҪʹFe3+��ȫ������c3(OH-)= Ksp[Fe(OH)3]/ 1.0��10-5=1.0��10-38/1.0��10-5=1.0��10-33�� ����c(OH-)=1.0��10-11mol/L��c(H+)=1.0��10-3����pH=3��ҪʹFe3+������ȫ�������ҺpHֵ��СΪ3���𰸣�SiO2 ��BaSO4��3��
(5) SrCl2��6H2O������61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��A���������60�����ˮԡ�����������о�Ĥ���֣��������SrCl2��6H2Oʧȥ�ᾧˮ�����ܼӿ����ʣ���A��ȷ��B����ΪSr�Ľ����Ժ�ǿ��Sr2+����Һ�в��ᷢ��ˮ�⣬���Բ������ȴ�ᾧ�����в���ͨ��HC1���壬��B����C������ݸ���SrCl2��6H2O������ü�ѹ������Լ���SrCl2��6H2O����ʧˮ����C��ȷ���𰸣�AC��
(6) Fe3+Ϊ��ɫ����SCN-����Һ��죻��Fe3+����Һ��ָʾ�������������һ��NH4 SCN��Һʱ����ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ��˵���ﵽ�ζ��յ㡣����AgSCN~NH4SCN��֪����AgSCN�����ʵ���n=0.02L��0.100mol/L-1=0.002mol����Cl-��Ӧ��Ag+Ϊ1.70g��170g/mol- 0.002mol=0.008mol������SrCl2��6H2O~2Ag+��֪n(SrCl2��6H2O)=0.004mol��SrCl2��6H2O����Ĵ���=(0.004mol![]() 267g/mol)�� 1.10g��100��=97.1�����𰸣����һ��NH4SCN��Һ���룬��ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ��97.1��
267g/mol)�� 1.10g��100��=97.1�����𰸣����һ��NH4SCN��Һ���룬��ƿ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ��97.1��


 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д� �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н��з�Ӧ:X(g)+3Y(g)![]() 2Z(g),�й�����ͼ���˵���������(����)
2Z(g),�й�����ͼ���˵���������(����)

A. ����ͼ���ж�����ӦΪ���ȷ�Ӧ
B. ��ͼ���У����߿ɱ�ʾʹ���˴���
C. ������Ӧ����H<0��ͼ���ɱ�ʾ�����¶�ʹƽ�����淴Ӧ�����ƶ�
D. ��ͼ��������ƽ����Է����������¶ȵı仯���������֪����Ӧ����H >0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ô�����CaCO3��100 mLϡ���ᷴӦ��ȡCO2��ʵ����̼�¼��ͼ��ʾ(CO2�����������Ϊ��״���µ����)�����з�����ȷ���ǣ� ��

A��OE�α�ʾ��ƽ���������
B��EF�Σ��������ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ0.4 mol��L��1��min��1
C��OE��EF��FG�����У��÷�Ӧ�ö�����̼��ʾ��ƽ����Ӧ����֮��Ϊ2��6��7
D��F���ռ�����CO2�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������ǿ������Һ����Ҫ��HO2-���ڡ��ҹ��о���Al-H2O2ȼ�ϵ�ؿ��������Դ�Ŀ��顢�������ȹ����Ƽ�����װ��ʾ��ͼ���¡�����˵���������
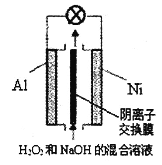
A. ��ع���ʱ����Һ��OH-ͨ�������ӽ���Ĥ��Al��Ǩ��
B. Ni���ĵ缫��Ӧʽ��HO2-+2e-+H2O=3OH-
C. ��ع��������������Һ��pH����
D. Al�缫��������13.5g����·��ͨ��9.03��1023������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ȼ��������Ⱦ�Խ����������磬�����˾ӻ���������Ҫ���塣
I����NH3����ԭNOx�������������������Ⱦ��NOx����NOΪ�����ں��������н��з�Ӧ��4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ��H<0��
5N2(g)+6H2O(g) ��H<0��
��1������ѡ������жϷ�Ӧ�ﵽƽ��״̬����_______��
A��.4v��(NH3)=5v��(N2) B����Ӧ��ϵ�������ܶȲ���
C��.��Ӧ��ϵ������ѹǿ���� D����Ӧ��ϵ������ƽ��Ħ����������
��2��ͼI�����߱�ʾת�����뷴Ӧʱ��Ĺ�ϵ�����ı���ʼ������ʹ��Ӧ������a״̬תΪb״̬���У��ɲ�ȡ�Ĵ�ʩ��_______

A�������¶� B������Ӧ����NO��Ũ��
C���Ӵ��� D�����ܱ�������ͨ�����
II��ȼú�����к��д���SO2��NO��ij����С���о����������ļ����շ�ͬʱ�ѳ�SO2��NO���գ���Ӧ������ͼII��ʾ��
��Ӧ1��NO(g)��O3(g)![]() NO2(g)��O2(g)
NO2(g)��O2(g)
��Ӧ2��SO2(g)��O3(g)![]() SO3(g)��O2(g)
SO3(g)��O2(g)

��֪����ϵ���¶�80�����ϳ��������ֽⷴӦ��2O3![]() 3O2����100��ʱ�����ķֽ���ԼΪ10������ش�
3O2����100��ʱ�����ķֽ���ԼΪ10������ش�
��1��д����Ӧ1���Ȼ�ѧ����ʽ_______����Ӧ1�ڸ����²����Է����У���÷�Ӧ���ر���S_______0����������������С��������
��2�������������䣬���������̶�Ϊ1L���ܱ������о����뺬1.0 mol NO��1.0 mol SO2��ģ��������2.0mol O3���ڲ�ͬ�¶��·�Ӧ��ͬʱ�����ϵ��NO��SO2��ת������ͼ��ʾ��

����P��Q����Ϊ��ƽ��㣬�Է���P��ת���ʴ���Q��Ŀ���ԭ��_______��100�棬t��ʱ��Ӧ1���е�P�㣬��Ӧ�ӿ�ʼ��t��ʱNO��ƽ������v(NO)=_______mol��L1��s1���ú�t��ʽ�ӱ�ʾ����
����Q��Ϊƽ��㣬100���·�Ӧ2��ƽ�ⳣ������ֵԼΪ_______����ȷ��0.01����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����50.00mLδ֪Ũ�ȵİ�ˮ����μ���0.5mol��L-1��HC1��Һ���ζ������У���Һ��pOH[pOH=��lgc(OH-)]�����HCl��Һ����Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����
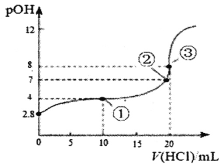
A. ͼ�Тڵ���ʾ��Һ�ĵ����������ڢٵ�
B. �۵㴦ˮ�������c(H+)=1��10-8mol��L-1
C. ͼ�е����ʾ��Һ�У�c(C1-)>c(NH4+)>c(OH-)>c(H+)
D. 25��ʱ��ˮ��KbԼΪ5��10-5.6mo1��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹż��еļ���˵������ȷ����
A. �����ݸ�Ŀ�����վ�����Ŀ��д����Ԫʱʼ���䷨����Ũ�ƺ�����굣���������������ˮ��ζ��Ũ�ң��Ǿ�¶Ҳ�����������õ���������ָ����
B. �����ϴ���������ࡷ������(��ͭ)�����ᣬ����������� �����˺Ͻ�Ӳ�ȷ��������
C. �����ݾ���ע���й��ڼ�����ʯ(KNO3)������(Na2SO4)�ļ��أ����Ի���֮����������������ʯҲ�����÷���Ӧ������ɫ��Ӧ
D. ������������ƪ���м��أ�����ɰ(HgS)��֮��ˮ���������ֳɵ�ɰ�����ù��̷����˷ֽ⡢���ϡ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1915��ŵ��������ѧ������Henry Bragg��Lawrence Bragg���Ա���������X���߶Ծ���ṹ�ķ��������Ĺ��ף�
(1)��ѧ��ͨ��X����̽����NaCl��KCl��MgO��CaO����ṹ���ƣ��������־���ľ������������±���

4�־���NaCl��KCl��MgO��CaO�۵��ɸߵ��͵�˳����__��
(2)��ѧ��ͨ��X�����Ʋ���мȺ�����λ�����ֺ����������ṹʾ��ͼ�ɼ�ʾ���£�������λ����������������߱�ʾ��

��д����̬Cuԭ�ӵĺ�������Ų�ʽ__������ͭ��������__������ĸ���ţ��ѻ���ʽ��

��д������������ˮ��ͭ���ӵĽṹ��ʽ�����뽫��λ����ʾ������__��
��ˮ���Ӽ��������������о�������ʵ˵�������ˮ�����ʵ�Ӱ��__��
��SO42���Ŀռ乹����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʾ4��װ��ͼ������˵������ȷ����

A. ��װ�ÿ����ڱȽ�NaHCO3��Na2CO3���ȶ��� B. �þƾ���ȡ��ˮ�е����ѡ���װ��
C. ���װ�ý���ʵ��ɿ�������KMnO4��Һ��ɫ D. ��װ�ÿ�����ʵ������ȡ���ռ�����SO2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com