
【题目】(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
①已知:放电时,负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2,则正极反应式为__。
②放电时,_____(填“正”或“负”)极附近溶液的碱性增强。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
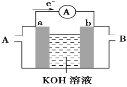
①使用时,空气从_____口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇(CH3OH),a极的电极反应式为__。
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】“烟气脱硫”是环境治理的重要工程,两种常见脱硫方法如下。回答相关问题:
方法I:用亚硫酸盐吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数与溶液pH的变化关系如图所示。

(1)若选用 (NH4)2SO3作为吸收液(已知NH3·H2O 的电离常数Kb=1.74×10-5):
①H2SO3的pKa1=________( pKa1 = -lgKa1);
②(NH4)2SO3溶液呈________(填“酸性”、“碱性”或“中性”),理由是________________;
③图中b点溶液中n(HSO3- ) : n(NH4+) =_________。
(2)若选用0.1mol/L 的Na2SO3作为吸收液,吸收过程中,下列有关粒子浓度关系一定正确的是(忽略溶液体积的变化)_________。
A.Na2SO3溶液中存在:c(Na+)>c(SO32-)>c(H2SO3)>c(HSO3-)
B.NaHSO3溶液中存在:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)
C.当吸收液呈中性时:2c(SO32-)+c(HSO3-)=0.2mol/L
D.当吸收液呈酸性时:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
方法II:用含铬废水吸收烟气中的SO2。吸收原理如图所示:

(3)“吸收”中反应的离子方程式为____________________
(4)欲使废水中的铬元素完全转化为Cr(OH)3沉淀,应调节pH的范围为____。(常温下Ksp[Cr(OH)3]=1.0×10-32)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)与时间(t)关系如右图。反应中镁和铝的
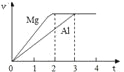
A. 物质的量之比为3:2 B. 质量之比为3:2
C. 摩尔质量之比为2:3 D. 反应速率之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是
编号 | 实验目的 | 实验方案 |
A | 探究催化剂对 | 两支试管中均盛有 |
B | 探究 | 向盛有 |
C | 比较 | 两支试管中分别放入已除去氧化膜、大小相同的镁条和铝条,再各加入 |
D | 制取并纯化氢气 | 向稀盐酸中加入纯锌粒,将生成的气体依次通过浓硫酸、 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①BaCl2固体 ②金刚石 ③NaOH固体 ④固体甲烷四种物质,按下列要求填空:
(1)熔化时不需要破坏化学键的是____(用序号填空,下同),只含离子键的是____,属于共价化合物的是____,熔点最高的是____。
(2)写出NaOH的电子式____,甲烷的空间构型____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 铜粉和镁粉的混合物分成2等份,将其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO
铜粉和镁粉的混合物分成2等份,将其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO![]() ;将另一份在空气中充分加热,最后得到mg固体.下列有关说法:
;将另一份在空气中充分加热,最后得到mg固体.下列有关说法:![]() ;
;![]() 无法计算硝酸的浓度;
无法计算硝酸的浓度;![]() ;
;![]() ,其中正确的是
,其中正确的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g),CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g),CH4的转化率与温度、压强的关系如下图。

①已知100 ℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为____。
②图中的P1___P2(填“<”、“>”或“=”),100 ℃时平衡常数为____。
③在其他条件不变的情况下降低温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
(2)在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) Ⅱ
CH3OH(g) Ⅱ
①该反应的ΔH______0,ΔS_____0(填“<”、“>”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是(____)
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:
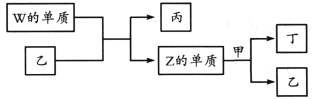
下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为部分短周期元素化合价及相应原子半径的数据:
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.186 |
最高化合价 | +6 | +5 | +4 | +5 | +7 | +1 | ||
最低化合价 | ﹣2 | ﹣3 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣1 | 0 |
已知:①A与D可形成化合物AD2、AD3,②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)用电子式表示A的氢化物与足量H 的最高价氧化物对应水化物反应生成的盐的形成过程:____________________________________________________________;
(2)E的简单气态氢化物极易溶于水的原因有:①_____________________________;
②____________________________________________。
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_______________。
(4)将标准状况下40L无色气体ED与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com