
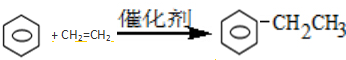 .
. 分析 ①CH2=CH-CH=CH2含有2个C=C键,与溴发生1:1加成时,可分别生成CH2Br-CHBrCH=CH2、CH2Br-CH=CH-CH2Br;
②苯和浓硝酸、浓硫酸混合液在60℃时反应生成硝基苯;
③苯与乙烯在催化剂条件下发生加成反应生成乙苯.
解答 解:①CH2=CH-CH=CH2含有2个C=C键,可与溴按1:2、1:4加成,1,2加成发生,反应方程式为:CH2=CH-CH=CH2+Br2→CH2Br-CHBrCH=CH2,1,4加成发生,反应方程式为:CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br,
故答案为:CH2=CH-CH=CH2+Br2→CH2Br-CHBrCH=CH2;CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br;
②将苯滴入浓硝酸和浓硫酸混合液中,并在50℃--60℃反应生成硝基苯和水,其反应的化学方程式为:C6H6+HNO3(浓)$→_{60℃}^{浓硫酸}$C6H5NO2 +H2O,
故答案为:C6H6+HNO3(浓)$→_{60℃}^{浓硫酸}$C6H5NO2 +H2O;
③苯与乙烯在催化剂条件下发生加成反应生成乙苯,化学方程式为: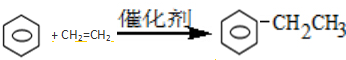 ,
,
故答案为: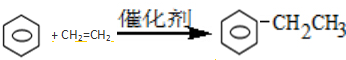 .
.
点评 本题考查化学方程式的书写,为高考高频点,明确有机物中官能团及其性质是解本题关键,知道反应时断键和成键方式,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | HX是弱酸,其c(OH-)是该盐酸中c(OH-)的104倍 | |
| B. | N点的pH>7的原因是由于NaOH过量所致 | |
| C. | M点c(HX)<c(X-) | |
| D. | P点c(Cl-)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
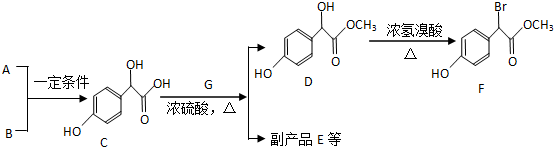
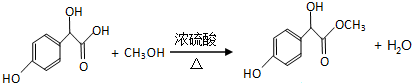
 .
.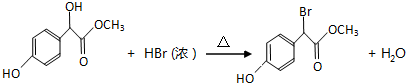
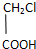
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. (或
(或 )(写出任一种的结构简式).
)(写出任一种的结构简式). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
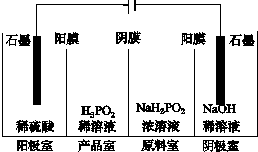 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把绿豆大的钾投入水中 | |
| B. | 把除去氧化膜的镁带放入少量冷水中 | |
| C. | 把溴水滴加到KI溶液中,并加入少量四氯化碳溶液 | |
| D. | 把铜片和铁片紧靠在一起浸入稀硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①②④⑤ | C. | ②⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com