
 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为: +(CH3CO)2O$→_{85-90℃}^{浓硫酸}$
+(CH3CO)2O$→_{85-90℃}^{浓硫酸}$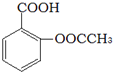 +CH3COOH操作流程如下:
+CH3COOH操作流程如下: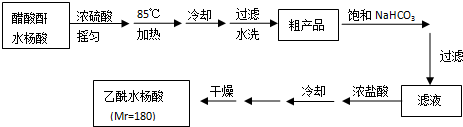
 .
. .
.分析 醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品,然后向粗产品中加入饱和碳酸氢钠溶液,使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,从而除去杂质;然后加入浓盐酸除去剩余的碳酸氢钠、将乙酰水杨酸钠转化为乙酰水杨酸,最后过滤、洗涤、干燥得到乙酰水杨酸.
(1)控制温度85℃,应采取水浴加热;
(2)水杨酸含有羧基和羟基,可以发生缩聚反应;
(3)①饱和NaHCO3可以使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离,当没有二氧化碳产生时,即可说明该过程结束;
②强酸可以制取弱酸,生成乙酰水杨酸,乙酰水杨酸微溶于水;
③水杨酸中含有酚羟基,遇FeCl3溶液发生显色反应;
(4)①羧基能与氢氧化钠反应,水解得到的酚羟基、乙酸与去氧化钠反应;
②计算乙酰水杨酸消耗的氢氧化钠的物质的量,结合乙酰水杨酸的物质的量是消耗的氢氧化钠的物质的量的$\frac{1}{3}$,可以得到阿司匹林药片中乙酰水杨酸质量分数.
解答 解:醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品,然后向粗产品中加入饱和碳酸氢钠溶液,使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,从而除去杂质;然后加入浓盐酸除去剩余的碳酸氢钠、将乙酰水杨酸钠转化为乙酰水杨酸,最后过滤、洗涤、干燥得到乙酰水杨酸.
(1)控制温度85℃,温度低于100℃,应采取水浴加热,受热均匀,便于控制温度,
故答案为:水浴加热;
(2)水杨酸含有羧基和羟基,可以发生缩聚反应生成高聚物,得到高聚物为: ,
,
故答案为: ;
;
(3)①用少量饱和NaHCO3溶解粗产品,目的是使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离,判断该过程结束的方法是没有CO2产生,
故答案为:使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离;没有CO2产生;
②滤液缓慢加入浓盐酸中,生成乙酰水杨酸,乙酰水杨酸微溶于水,所以会有浑浊产生,
故答案为:有浑浊产生;
③酚羟基能和氯化铁发生显色反应,检验最终产品中是否含有水杨酸的化学方法是:取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫色则含水杨酸,
故答案为:取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫色则含水杨酸;
(4)①羧基能与氢氧化钠反应,水解得到的酚羟基、乙酸与去氧化钠反应,反应方程式为: ,
,
故答案为: ;
;
②乙酰水杨酸消耗的氢氧化钠的物质的量为:aV1×10-3-bV2×10-3,乙酰水杨酸的物质的量是消耗的氢氧化钠的物质的量的$\frac{1}{3}$,阿司匹林药片中乙酰水杨酸质量分数的表达式为$\frac{0.180(aV{\;}_{1}-bV{\;}_{2})}{3m}$,
故答案为:$\frac{0.180(aV{\;}_{1}-bV{\;}_{2})}{3m}$.
点评 本题考查有机物的制备与合成,关键是明确实验原理与官能团的性质,注意对题目信息的应用,掌握物质分离提纯常用方法,较好的考查学生分析能力与知识迁移应用,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(CH2Br)2 | B. | (CH3)2BrCH2Br | C. | C2H5CHBrCH2Br | D. | CH3(CHBr)2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氟乙烯为非极性分子 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯的分子结构可能为【-CF2-CF2--CF2-CF--CF3-】 | |
| D. | ETFE中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
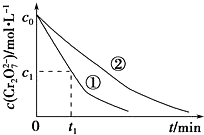 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | V1 | 20 |
| 实验方案 | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
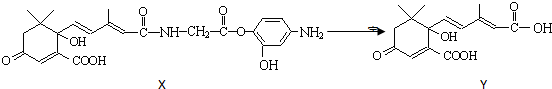 ( )
( )| A. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| B. | 1 molY与足量NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 1 molX最多能加成9 molH2 | |
| D. | X可以发生氧化、取代、酯化、加聚、缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明陶瓷材料硒化锌 | B. | 半导体材料砷化镓 | ||
| C. | 吸氢材料镧镍合金 | D. | 超导材料K3C60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com