
元素周期律和周期表,揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面都有重要意义。下表为元素周期表的一部分,请参照元素a~h在表中的位置,回答下列问题:


(1)这8种元素中金属性最强的元素是______,元素最高价氧化物对应的水化物中酸性最强的是______(填元素符号或化学式,下同);
(2)c元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___________;
(3)c、e、g三种元素按原子半径由大到小的顺序排列为___________;
(4)由a、d、e三种元素形成的既含离子键又含共价键的离子化合物的电子式为______________。
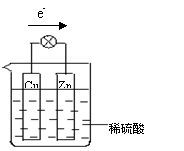
(5)若用球棍模型表示a和d形成的化合物的分子结构,应该是_____________。
 |
(6)某原电池,如右图所示:Cu是 极(填“正”或“负”),电极反应式为 ;
Zn是 极(填“正”或“负”),电极反应式为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池负极反应式为:O2 + 2H2O + 4e— = 4OH—
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
A.曲线I中滴加溶液到10 mL时:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线I中滴加溶液到25 mL时:
c(NH4+)>c(C1-)>c(H+)>c(OH-)
C.曲线II中滴加溶液在10 mL~25 mL之间存在:
c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II中滴加溶液到10mL时:
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中书写正确的是
A.金属钠与水反应:Na +2H2O=Na++2OH-+H2↑
B.用氢氧化钡溶液中和硫酸溶液:Ba2++SO42-= BaSO4↓
C.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
D.向碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+OH-=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各式中,属于正确的电离方程式的是
A.HCO3- + H2O  H2CO3 + OH- B.HCO3- +OH- === H2O + CO32-
H2CO3 + OH- B.HCO3- +OH- === H2O + CO32-
C.NH3 + H+ === NH4+ D.NH3·H2O  NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度条件下,下列有关一定物质的量浓度的氨水说法正确的是
A.氨水促进了水的电离 B. 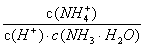 是个常数
是个常数
C.NH3·H2O电离达到平衡的标志是溶液呈电中性
D.c(NH )+c(H+)=c(NH3·H2O)+c(OH-)
)+c(H+)=c(NH3·H2O)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,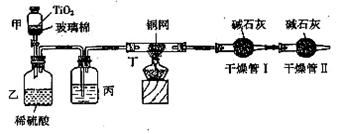 先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
CN-被处理的百分率。
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.2 mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。
丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅱ的作用是 。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比
__________(填“偏高”或“偏低”),简述可能的原因: 。
(4)若干燥管Ⅰ中碱石灰增重1.408 g,则该实验中测得CN-被处理的百分率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A. 常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com