
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:①>② B.原子半径:④>③
C.电负性: ②>③ D.氢化物稳定性:①>②
D
【解析】
试题分析:①是S;②是P;③N;④是F。A.一般情况下,同一周期的元素,原子序数越大,原子半径越小,第一电离能就越大。但是当原子核外 电子在轨道上处于全充满、半充满或全空时是稳定的,失去电子较难,第一电离能较大。因此第一电离能:②>①。错误。B.N、F是同一周期的元素,原子序数越大,原子半径就越小。因此原子半径:③>④。错误。C.元素的非金属性越强,其电负性就越大。非金属性N>P,所以电负性:③>②。错误。D.元素的非金属性越强,其简单的氢化物的稳定性就越强,非金属性S>P氢化物稳定性:①>②。周期。
考点:考查元素的非金属性、第一电离能、原子半径、电负性及氢化物的稳定性的比较的知识。


科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.NH3的结构式为: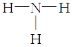 B.乙烯的结构简式: CH2CH2
B.乙烯的结构简式: CH2CH2
C.CH4 分子的比例模型: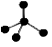 D.-CH3(甲基)的电子式为:
D.-CH3(甲基)的电子式为: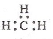
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:填空题
(8分)选择以下物质填写下列空白:
A.氢氧化钠 B.氧化镁 C.He D.二氧化硅
E.氯化铵 F.碘晶体 G.二氧化硫 H.钾
(1)晶体中存在分子的是 。(2)晶体中既有离子键又有共价键的是 。
(3)融化时需要破坏共价键的是 。(4)最易溶于水的分子晶体是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
X、Y、Z是短周期的三种主族元素,在周期表中的相对位置如图所示,下列说法正确的是
X | |
Y | Z |
A.原子半径:X<Y<Z
B.X、Y、Z三种元素的最高价氧化物对应水化物中最多有一种强酸
C.X的气态氢化物的稳定性比Y的气态氢化物强
D.常温下X、Y、Z的单质不可能均与盐酸反应
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:填空题
已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题(H2O相对分子质量为18):
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 _ __570 kJ(填“>”、“<”或“=”)。
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4 完全燃烧生成CO2气体和H2O(l)的热化学方程式为 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。
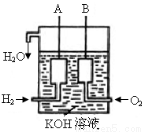
该电池的正极为:______(填A或B)。电极反应式为 ________ ____ 。
(4)若将上述装置中通入H2的改成CH4气体,也可以组成一个原电池装置,电池的总反应为:CH4+2O2+2KOH = K2CO3+3H2O ,则该电池的负极反应式为:______ _ _ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度,为了“减缓反应进行的速率,但又不影响生成H2的总量”,可向反应物中加入适量的 ( )
A.Na2CO3溶液 B.Na2CO3固体 C.水 D.NaNO3固体
查看答案和解析>>
科目:高中化学 来源:2013-2014福建安溪一中、惠安一中、养正中学下学期期中高二化学(解析版) 题型:填空题
(6分) 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
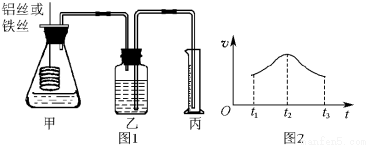
(1)检查图1所示装置气密性的方法是____________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量__________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省高二下学期期末考试化学试卷(解析版) 题型:选择题
根据有机化合物的命名原则,下列命名不正确的是( )
A.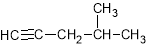 :4-甲基-1-戊炔
:4-甲基-1-戊炔
B.CH3CH(CH3)CH=CHCH3:2-甲基-3-戊烯
C.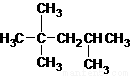 :2,2,3-三甲基戊烷
:2,2,3-三甲基戊烷
D. :间二硝基苯
:间二硝基苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com