
| A. | 2Fe2十+Cl2═2Fe3++2Cl- | B. | 2Fe2十+O2═2Fe3++2I- | ||
| C. | I2+SO2+2H2O═H2SO4+2HI | D. | SO2+O2+2H2O═H2O2+H2SO4 |
分析 根据氧化还原反应的强弱规律,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物;在酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-,在溶液中进行的反应只能前面的粒子还原后面的,否则反应不能发生,据此对各选项进行解答.
解答 解:A.2Fe2++Cl2=2Fe3++2Cl-反应中,还原剂Fe2+的还原性大于还原产物Cl-,符合题给条件,该反应可以发生,故A错误;
B.反应2Fe2十+O2═2Fe3++2I-中,亚铁离子还原性大于I-,与题干信息不相符,该反应不能发生,故B正确;
C.I2+SO2+2H2O=H2SO4+2HI反应中,还原剂SO2的还原性大于还原产物Fe2+,该反应可以发生,故C错误;
D.SO2+O2+2H2O═H2O2+H2SO4,根据元素化合价可知,反应中硫元素化合价升高,氧气中氧元素化合价降低,二氧化硫为还原剂,硫酸为还原产物,还原剂的还原性大于还原产物,即SO2>H2O2,和题意相符,该反应能发生,故D错误;
故选B.
点评 本题考查了氧化还原反应的强弱规律的应用,题目难度中等,注意掌握氧化还原反应的特征及氧化性、还原性强弱大小的判断方法,明确溶液中进行的反应,必须满足:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①的离子浓度为:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | ②c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| C. | ③加入等体积的水稀释,电离平衡正向移动,c(H+)增大 | |
| D. | ④和③等体积混合,c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
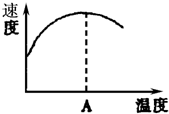 酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.
酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应:
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应: 模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.

 的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).
的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com