
【题目】下列叙述正确的是( )
A. 1 mol H2O的质量为18g/mol
B. CH4的摩尔质量为16g
C. 3.01×1023个SO2分子的质量为32g
D. 标准状况下,1 mol任何物质体积均为22.4L
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”;G能与NaHCO3溶液反应放出CO2气体。
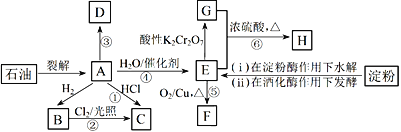
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。
反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
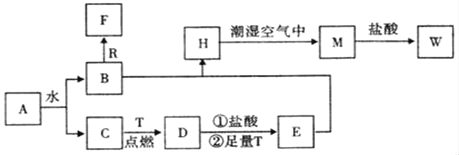
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化物法生产亚氯酸钠的工艺流程图:
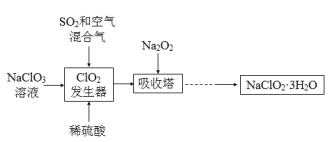
已知:
①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释至10%以下较安全;
(1)NaClO2中Cl的化合价为______。
(2)在发生器中鼓入SO2和空气混合气的原因是______ (填序号)。
A 空气稀释ClO2以防止爆炸
B SO2将NaClO3氧化成ClO2
C 稀硫酸可以增强NaClO3的氧化性
(3)Na2O2可改为H2O2和NaOH的混合溶液,吸收塔中发生的反应的化学方程式______;吸收塔的温度不能超过20oC,主要原因是______。
(4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是______ (填序号)。
A 蒸馏 B 蒸发浓缩 C 灼烧 D 过滤 E 冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:
甘油水蒸气重整 (SPG) | C3H8O3(1)+3H2O(g) | 反应I |
甘油部分氧化 (POG) | C3H8O3(1)+ | 反应II |
甘油氧化水蒸气 重整(OSRG) | C3H8O3(1)+ | 反应III |
(1)下列说法正确的是________(填字母序号)。
a. 消耗等量的甘油,反应I的产氢率最高
b. 消耗等量的甘油,反应Ⅱ的放热最显著
c. 经过计算得到反应Ⅲ的 △H3=-237.5 kJ·mol-1
d. 理论上,通过调控甘油、水蒸气、氧气的用量比例可以实现自热重整反应,即焓变约为0,这体现了科研工作者对吸热反应和放热反应的联合应用
(2)研究人员经过反复试验,实际生产中将反应Ⅲ设定在较高温度(600~700℃)进行,选择该温度范围的原因有:催化剂活性和选择性高、__________。
(3)研究人员发现,反应I的副产物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO,CH3COOH等,为了显著提高氢气的产率,采取以下两个措施。
①首要抑制产生甲烷的副反应。从原子利用率角度分析其原因:___________。
②用CaO吸附增强制氢。如图1所示,请解释加入CaO的原因:__________。

(4)制备高效的催化剂是这种制氢方法能大规模应用于工业的重要因素。通常将Ni分散在高比表面的载体(SiC、Al2O3、CeO2)上以提高催化效率。分别用三种催化剂进行实验,持续通入原料气,在一段时间内多次取样,绘制甘油转化率与时间的关系如图2所示。
①结合图2分析Ni/SiC催化剂具有的优点是_________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(La2O3)可有效减少积碳。其反应机理包括两步:
第一步为:La2O3+CO2![]() La2O/span>2CO3
La2O/span>2CO3
第二步为:__________(写出化学反应方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以惰性电极电解CuSO4和NaCl的混合溶液,两电极上产生的气体(标准状况下测定)体积如下图所示,下列有关说法正确的是

A.a表示阴极上产生的气体,t1前产生的为Cl2
B.原溶液中CuSO4和NaCl物质的量之比为1:1
C.若t2时溶液的体积为1 L,此时溶液的pH为13
D.若原溶液体积为1 L,则原溶液中SO42的物质的量浓度为0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质的量之比为3∶5,则参加反应的Cl2与NaOH物质的量之比为( )
A. 8∶11 B. 3∶5 C. 1∶2 D. 18∶8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )
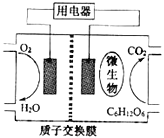
A. 该电池能够在高温下工作
B. 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C. 放电过程中,质子(H+)从负极区向正极区迁移
D. 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaF2 | SO3 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com