
【题目】运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3:
![]()
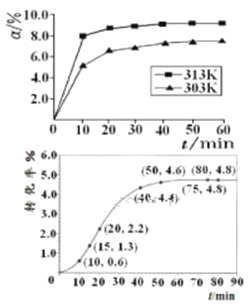
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=______,该反应中的![]() ____0(填“>”“<”或“=”)。
____0(填“>”“<”或“=”)。
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(1)发生反应,N2转化率随时间(t)变化如图。15-20min内,v(NH3)=____。若其他条件不变,在图中画出使用催化剂后N2的转化率随反应时间变化的曲线示意图_______。
(2) 25℃时,某同学将0.lmol![]() 盐酸与0.2 mol
盐酸与0.2 mol![]() 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中c(NH4+)______c(NH3
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中c(NH4+)______c(NH3![]() H2O)(25℃时,NH3.H2O的电离常数
H2O)(25℃时,NH3.H2O的电离常数![]() )
)
(3) 25℃时,向0.lmol![]() 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol![]() 氨水,有白色沉淀生成,向反应后的浊液中,继续加入0.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入0.lmol![]() 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,![]() ,
,![]() )
)
【答案】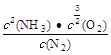 > 0.0018mol·L-1·min-1
> 0.0018mol·L-1·min-1 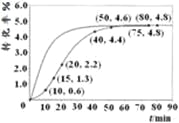 > > 白色沉淀逐渐变成红褐色 Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+、2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)
> > 白色沉淀逐渐变成红褐色 Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+、2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)
【解析】
(1)①根据平衡常数的含义,可得该反应的平衡常数K=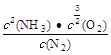 ;根据图像可知,温度升高,生成物NH3的体积分数逐渐增大,说明平衡向右移动,则该反应为吸热反应,H > 0。
;根据图像可知,温度升高,生成物NH3的体积分数逐渐增大,说明平衡向右移动,则该反应为吸热反应,H > 0。
故答案为: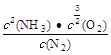 ;>;
;>;
②根据图像,15min时N2的转化率为1.3%,20min时N2的转化率为2%,则v(NH3)=2v(N2)=2×1mol×(2.2%-1.3%)÷2L÷5min=0.0018mol·L-1·min-1;使用了催化剂,反应速率加快,但平衡不移动,可画出曲线如图 。
。
故答案为:0.0018mol·L-1·min-1; ;
;
(2)0.l molL1盐酸与0.2 molL1氨水等体积混合,所得混合溶液含有等量的NH4Cl和NH3H2O,溶液呈碱性,则pH > 7;NH3H2O的电离程度大于NH4Cl的水解程度,所以c(NH4+)>c(NH3H2O)。
故答案为:>;>;
(3)根据Mg(OH)2和Fe(OH)3的Ksp可知生成Fe(OH)3沉淀时OH的浓度更小,所以Mg(OH)2沉淀会转化为Fe(OH)3沉淀,白色沉淀逐渐变成红褐色;先后发生反应的离子方程式为:Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+;2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)。
故答案为:白色沉淀逐渐变成红褐色;Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+、2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加徳罗常数的值,下列说法正确的是
A.12g石墨烯(单层石墨)中含有六元环的个数为2NA
B.标准状况下,22.4LHF中含有的氟原子数目为NA
C.密闭容器中,lmolNH3和lmolHC1反应后气体分子总数为NA
D.在1L 0.1 mol/L的硫化钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种新型的应用于液晶和医药的材料W和Z,可用以下路线合成。
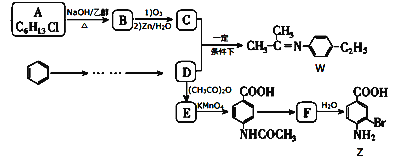
已知以下信息:
① (R1、R2、R3、R4为氢原子或烷烃基)
(R1、R2、R3、R4为氢原子或烷烃基)
②1molB经上述反应可生成2molC,且C不能发生银镜反应
③![]() (易被氧化)
(易被氧化)
④![]() +CH3-CH=CH2
+CH3-CH=CH2 ![]()
请回答下列问题:
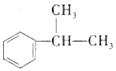
(1)化合物A的结构简式____________,A→B的反应类型为_______________。
(2)下列有关说法正确的是____________(填字母)。
A.化合物B中所有碳原子不在同一个平面上
B.化合物W的分子式为C11H16N
C.化合物Z的合成过程中,D→E步骤为了保护氨基
D.1mol的F最多可以和4 molH2反应
(3)C+D→W的化学方程式是________________________。
(4)写出同时符合下列条件的Z的所有同分异构体的结构简式:_____________________。
①遇FeCl3溶液显紫色;
②红外光谱检测表明分子中含有![]() 结构;
结构;
③1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。
(5)设计 →D合成路线(用流程图表示,乙烯原料必用,其它无机过剂及溶剂任选)______________。
→D合成路线(用流程图表示,乙烯原料必用,其它无机过剂及溶剂任选)______________。
示例:CH3CHO ![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。
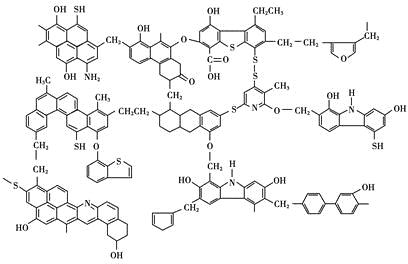
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(选修3物质结构与性质)(15分)
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
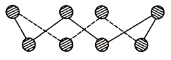
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离
子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 ;
(4)H2Se的酸性比H2S (填“强”或“弱”)。气态SeO3分子的立体构型
为 ,SO32-离子的立体构型为 ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,
K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
;
② H2SeO4比 H2SeO3酸性强的原因:
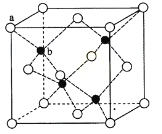
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为 (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为 pm(列示表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
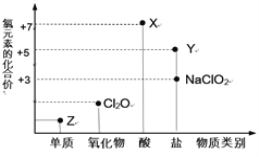
回答下列问题:
(1)X的电离方程式为_________。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n= _________。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的 ___________倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________。
(6)自来水中的![]() 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中![]() 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原![]() ,产物是N2。发生的反应可表示如下,请完成方程式的配平:___Al+ ____
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___Al+ ____![]() + _____=___
+ _____=___![]() + _____ N2↑ + _______H2O
+ _____ N2↑ + _______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玫瑰的香味物质中包含苧烯,苧烯的键线式为:![]() 。
。
(1)1 mol苧烯最多可以跟________mol H2发生反应。
(2)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构______________(用键线式表示)。
(3)有机物A是苧烯的同分异构体,分子中含有“![]() ”结构,A可能的结构为_______________(用键线式表示)。
”结构,A可能的结构为_______________(用键线式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
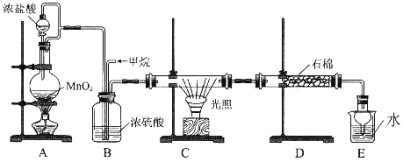
(1)最简单烷烃的空间结构为_______________。
(2)写出装置C中生成一氯甲烷的化学方程式:__________,该反应类型为:_________。
(3)D中石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(4)若题目中甲烷与氯气的体积之比为1∶1,两者反应则得到的产物有____种,其中常温下为气态的有机产物的化学式为:________。
(5)将0.4molCH4与Cl2发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
(6)烃A为甲烷的同系物,A中有12个氢原子,写出A的同分异构体中,含4个-CH3的结构简式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中加入过量Na2O2后仍能大量共存的是
A.NH![]() 、Ba2+、Cl-、NO
、Ba2+、Cl-、NO![]() B.K+、SiO
B.K+、SiO![]() 、AlO
、AlO![]() 、SO
、SO![]()
C.Fe2+、Mg2+、SCN-、Cl-D.Na+、SO![]() 、I-、HCO
、I-、HCO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com