
| A. | 5:1 | B. | 4:1 | C. | 3:2 | D. | 1:5 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题

 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、CO32- | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、NO3- | D. | Na+、Mg2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Mg和Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中,硫元素被氧化 | |
| B. | 上述反应中,Y为氮气 | |
| C. | 红色固体是氧化亚铜 | |
| D. | 98g H2SO4参与反应,必转移0.5NA个电子(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,$\frac{c({F}^{-})}{c(HF)}$始终保持增大 | |
| B. | 浓度均为0.1mol•L-1的Na2SO3、NaHSO3混合溶液中:3c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | 在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,恰好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol•L-1 | |
| D. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
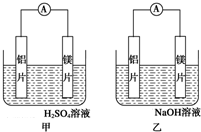 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒容通入惰性气体 | B. | 恒压时通入惰性气体 | ||
| C. | 恒容通入COCl2气体 | D. | 加催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸 | |
| B. | 在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素 | |
| C. | 镭(第ⅡA族)的硫酸盐难溶解于水,其氢氧化物是强碱 | |
| D. | 溴化氢没有氯化氢稳定,其水溶液的还原性是盐酸弱于氢溴酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com