
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2作为反应物,转移电子数一定为2NA | |
| B. | 25℃时,1.0LpH=13的Ba(OH)2溶液中水电离的OH-数目为0.1NA | |
| C. | 17g烃基和17gOH-含有的电子数均为10NA | |
| D. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体分子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
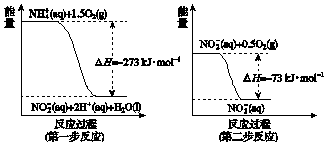
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
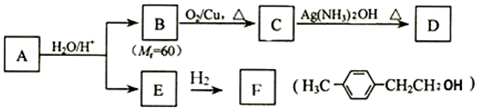
 .
. (其中一种).
(其中一种). )的合成路线.
)的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=2b时,生成沉淀98.5ag | |
| B. | a≤b≤2a时,溶液中含n(NaOH):n(Na2CO3)=(2a-b):(b-a) | |
| C. | 0<b<2a时,沉淀质量随着NaHCO3的加入而不断增加 | |
| D. | b=$\frac{3}{2}$a时,总离子方程式为:3HCO3-+2Ba2++3OH-=2BaCO3↓+CO32-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:X<W<Z | |
| B. | W、X、Y元素形成的盐溶于水,溶液一定呈中性 | |
| C. | W与X形成的常见化合物中阴、阳离子个数比均为1:2 | |
| D. | 1 mol Z 的单质与足量的NaOH溶液反应转移电子数1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com