
分析 ①蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成;
②天然蛋白质是α-氨基酸形成的;
③盐析一般是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程;
④必需氨基酸指的是人体自身不能合成或合成速度不能满足人体需要,必须从食物中摄取的氨基酸.
解答 解:①蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成,一般蛋白质可能还会含有P、S、Fe(铁)、Zn(锌)、Cu(铜)等,故答案为:C、H、O、N;
②天然蛋白质水解的最终产物是α-氨基酸,故答案为:α-氨基酸;
③蛋白质溶液遇到浓的硫酸铵等无机盐溶液发生盐析,故答案为:盐析;
④必需氨基酸指的是人体自身不能合成或合成速度不能满足人体需要,必须从食物中摄取的氨基酸.故答案为:必需.
点评 本题主要考查蛋白质的性质,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.


科目:高中化学 来源: 题型:实验题
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
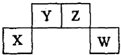 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )| A. | 常温下X的单质投入浓硫酸中没有明显现象 | |
| B. | Y的氢化物只有一种 | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物排放不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:Cu2++2e-═Cu | |
| B. | 阳极反应:2Cu-2e-+2I-═2CuI 阴极反应:2H++2e-═H2↑ | |
| C. | 阳极反应:2I--2e-═I2 阴极反应:2H++2e-═H2↑ | |
| D. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、CO32-、NO3- | B. | K+、Na+、NO3-、SO42- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Na+、K+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com