
 6CuFeS2+19O2
6CuFeS2+19O2 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2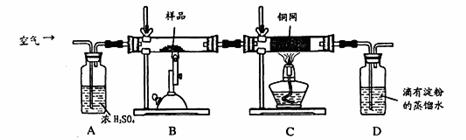
 气充分反应 b.除去空气中的水份
气充分反应 b.除去空气中的水份 +H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32) 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
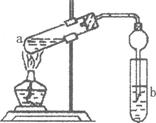
 (一)甲组:实验方案:镁铝合金
(一)甲组:实验方案:镁铝合金 测定剩余固体质量
测定剩余固体质量 盘天平称量一定质量镁铝合金粉末
盘天平称量一定质量镁铝合金粉末 (二)乙组:实验方案:镁铝合金
(二)乙组:实验方案:镁铝合金 测定生成气体的体积
测定生成气体的体积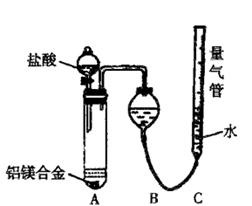

 并最终得到固体物质1.45g。则该合金中铝的质量分数为 。
并最终得到固体物质1.45g。则该合金中铝的质量分数为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 待测草酸溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) |
| ① | 25.00 | 0.00 | 10.00 m |
| ② | 25.00 | 1.00 | 11.02 |
| ③ | 25.00 | 0.22 | 12.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 猜想 | 实验操作 | 预期现象 |
| 猜想一:Fe元素只显______价 | ①向所得溶液中滴入KSCN溶液 ②向稀酸性KMnO4溶液中滴入所得溶液 | KSCN溶液无明显现象 |
| 猜想二;Fe元素只显______价 | 稀酸性KMnO4溶液颜色_____ | |
| 猜想三:Fe元素既有+2价又有+3价 | KSCN溶液呈______色 稀酸性KMnO4溶液颜色______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
| C | H+浓度相同的盐酸和硫酸分别与等质量的形状相同的锌粒反应 | 反应开始速率相同 |
| D | 在容积可变的密闭容器中发生反应H2(g)+ I2(g)  2HI(g),把容积缩小一倍 2HI(g),把容积缩小一倍 | 反应速率不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠和镁分别与冷水反应,判断钠和镁金属性强弱 |
| B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 |
| C.硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 |
| D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com