
| A. | 空气中结构式为O-C-O的分子含量过多会造成温室效应 | |
| B. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[ ]2-Na+和 ]2-Na+和 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
分析 A.二氧化碳能造成温室效应,但二氧化碳结构式错误;
B.当n=16时为硫离子,硫离子能够促进水的电离;
C. 为比例模型,不是球棍模型;
为比例模型,不是球棍模型;
D.Na+[ ]2-Na+和
]2-Na+和 分别为过氧化钠、过氧化氢的电子式.
分别为过氧化钠、过氧化氢的电子式.
解答 解:A.空气中二氧化碳分子含量过多会造成温室效应,二氧化碳分子中含有两个碳氧双键,不是单键,其结构式为O=C=O,故A错误;
B.结构示意图为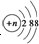 的阴离子可能为硫离子,硫离子结合水电离的氢离子,能够促进水的电离,故B错误;
的阴离子可能为硫离子,硫离子结合水电离的氢离子,能够促进水的电离,故B错误;
C. 为乙烯的比例模型,乙烯的球棍模型为:
为乙烯的比例模型,乙烯的球棍模型为: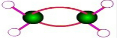 ,故C错误;
,故C错误;
D.Na+[ ]2-Na+为过氧化钠,
]2-Na+为过氧化钠, 为过氧化氢,二者都具有强氧化性,为常见的氧化剂,故D正确;
为过氧化氢,二者都具有强氧化性,为常见的氧化剂,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及球棍模型与比例模型、离子结构示意图、电子式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应完全停止 | B. | 反应达到平衡状态 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和苯都能发生取代反应 | |
| B. | 甲烷和乙烯通常都是气体,可用溴水进行鉴别 | |
| C. | 甲烷和苯都无还原性,乙烯有还原性 | |
| D. | 乙烯和苯都能与氢气发生加成反应,反应产物都属于烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的负极材料可选用多空隙的石墨 | |
| B. | 电池的正极反应为:3SOCl2+8e-═SO${\;}_{3}^{2-}$+2S+6Cl- | |
| C. | 电池的电解质溶液可选用稀盐酸 | |
| D. | 上述反应中,每转移4mol电子,生成氧化产物32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含有食品添加剂的食物对人体健康有害,不宜食用 | |
| B. | 乙醇和汽油都属于可再生能源,应大力推广使用乙醇汽油 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | PM2.5是指大气中直径≤2.5微米的颗粒物,其颗粒直径小,面积大,活性强,易附带有毒、有害物质(如重金属、微生物等),对人体健康和大气环境质量的影响很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向25mL冷水与沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| B | 淀粉在稀硫酸的作用下水解后,滴加NaOH溶液至碱性,再加入新制Cu(OH)2后加热 | 有砖红色沉淀生成 | 淀粉已经完全水解 |
| C | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| D | 向饱和Na2CO3溶液中加入BaSO4固体,振荡、过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)>Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
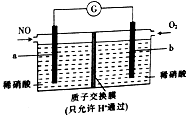 用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )
用NO生产硝酸,可以有效消除污染,其原理如图所示.下列说法正确的是( )| A. | a极是该电极的正极 | |
| B. | 电流由a极经导线流向b极 | |
| C. | a极的电极反应式为NO-3e-+2H2O═NO3-+4H+ | |
| D. | 若消耗2.24L(标准状况下)氧气,则会有0.4 molH+通过质子交换膜进入a极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
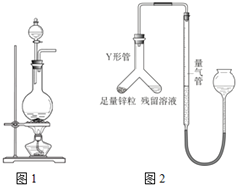 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com