
”¾ĢāÄæ”æ½üÄźĄ“£¬ĖęמŪõ„¹¤ŅµµÄæģĖŁ·¢Õ¹£¬ĀČĘųµÄŠčĒóĮæŗĶĀČ»ÆĒāµÄ²ś³öĮæŅ²ĖęÖ®ŃøĖŁŌö³¤”£Ņņ“Ė£¬½«ĀČ»ÆĒā×Ŗ»ÆĪŖĀČĘųµÄ¼¼Źõ³ÉĪŖæĘѧъ¾æµÄČČµć”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Deacon·¢Ć÷µÄÖ±½ÓŃõ»Æ·ØĪŖ£ŗ4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)”£ĻĀĶ¼ĪŖøÕŠŌČŻĘ÷ÖŠ£¬½ųĮĻÅØ¶Č±Čc(HCl) ”Ćc(O2)·Ö±šµČÓŚ1”Ć1”¢4”Ć1”¢7”Ć1Ź±HClĘ½ŗā×Ŗ»ÆĀŹĖęĪĀ¶Č±ä»ÆµÄ¹ŲĻµ£ŗ
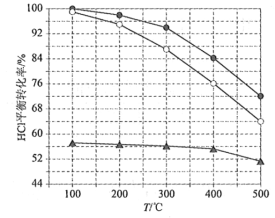
æÉÖŖ·“Ó¦Ę½ŗā³£ŹżK£Ø300”ę£©____________K£Ø400”ę£©£ØĢī”°“óÓŚ”±»ņ”°Š”ÓŚ”±£©”£ÉčHCl³õŹ¼ÅضČĪŖc0£¬øł¾Ż½ųĮĻÅØ¶Č±Čc(HCl)”Ćc(O2)=1”Ć1µÄŹż¾Ż¼ĘĖćK£Ø400”ę£©=____________£ØĮŠ³ö¼ĘĖćŹ½£©”£°“»Æѧ¼ĘĮæ±Č½ųĮĻæÉŅŌ±£³Ö·“Ó¦Īļøß×Ŗ»ÆĀŹ£¬Ķ¬Ź±½µµĶ²śĪļ·ÖĄėµÄÄÜŗÄ”£½ųĮĻÅØ¶Č±Čc(HCl)”Ćc(O2)¹żµĶ”¢¹żøߵIJ»ĄūÓ°Ļģ·Ö±šŹĒ____________”£
£Ø2£©DeaconÖ±½ÓŃõ»Æ·ØæÉ°“ĻĀĮŠ“߻ƹż³Ģ½ųŠŠ£ŗCuCl2(s)=CuCl(s)+![]() Cl2(g) ¦¤H1=83 kJ”¤mol-1£¬CuCl(s)+
Cl2(g) ¦¤H1=83 kJ”¤mol-1£¬CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ¦¤H2=-20 kJ”¤mol-1£¬CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ¦¤H3=-121 kJ”¤mol-1£¬Ōņ4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)µÄ¦¤H=_________ kJ”¤mol-1”£
Cl2(g) ¦¤H2=-20 kJ”¤mol-1£¬CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ¦¤H3=-121 kJ”¤mol-1£¬Ōņ4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)µÄ¦¤H=_________ kJ”¤mol-1”£
£Ø3£©ŌŚŅ»¶ØĪĀ¶ČµÄĢõ¼žĻĀ£¬½ųŅ»²½ĢįøßHClµÄ×Ŗ»ÆĀŹµÄ·½·ØŹĒ______________”££ØŠ“³ö2ÖÖ£©
”¾“š°ø”æ“óÓŚ ![]() O2ŗĶCl2·ÖĄėÄÜŗĽĻøß”¢HCl×Ŗ»ÆĀŹ½ĻµĶ ©116 Ōö¼Ó·“Ó¦ĢåĻµŃ¹Ē攢¼°Ź±³żČ„²śĪļ
O2ŗĶCl2·ÖĄėÄÜŗĽĻøß”¢HCl×Ŗ»ÆĀŹ½ĻµĶ ©116 Ōö¼Ó·“Ó¦ĢåĻµŃ¹Ē攢¼°Ź±³żČ„²śĪļ
”¾½āĪö”æ
(1)½įŗĻĶ¼ĻóæÉÖŖ£¬½ųĮĻÅØ¶Č±ČĻąĶ¬Ź±£¬ĪĀ¶ČŌ½øßHClĘ½ŗā×Ŗ»ÆĀŹŌ½µĶ£¬ĖµĆ÷øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāĻņ×ÅÄęĻņŅĘ¶Æ£¬ĪĀ¶ČŌ½øßĘ½ŗā³£ŹżŌ½Š”£»½ųĮĻÅØ¶Č±Čc(HCl)£ŗc(O2)µÄ±ČÖµŌ½“ó£¬HClµÄĘ½ŗā×Ŗ»ÆĀŹŌ½µĶ£¬øł¾ŻĶ¼ĻóæÉÖŖ£¬ĻąĶ¬ĪĀ¶ČŹ±HCl×Ŗ»ÆĀŹ×īøßµÄĪŖ½ųĮĻÅØ¶Č±Čc(HCl)£ŗc(O2)=1£ŗ1£¬øĆĒśĻßÖŠ400”ęHClµÄĘ½ŗā×Ŗ»ÆĀŹĪŖ84%£¬
4HCl(g)+O2(g)ØT2Cl2(g)+2H2O(g)
³õŹ¼ c0 c0 0 0
Ę½ŗā 0.84c0 0.21c0 0.42c0 0.42c0
×Ŗ»Æc0-0.84c0c0-0.21c0 0.42c00.42c0
“ųČėK=![]() ¼ĘĖć¼“æÉ£»
¼ĘĖć¼“æÉ£»
½ųĮĻÅØ¶Č±Čc(HCl)£ŗc(O2)¹żµĶŹ±£¬O2ÅØ¶Č½Ļ“ó£¬Cl2ŗĶO2·ÖĄėÄÜŗĽĻøߣ»½ųĮĻÅØ¶Č±Čc(HCl)£ŗc(O2)¹żøߏ±£¬O2ÅØ¶Č¹żµĶ£¬HClµÄ×Ŗ»ÆĀŹ¼õŠ”£»
(2)¢ŁCuCl2(s)ØTCuCl(s)+![]() Cl2(g)”÷H1=83kJmol-1£¬¢ŚCuCl(s)+
Cl2(g)”÷H1=83kJmol-1£¬¢ŚCuCl(s)+![]() O2(g)ØTCuO(s)+
O2(g)ØTCuO(s)+![]() Cl2(g)”÷H2=-20kJmol-1£¬¢ŪCuO(s)+2HCl(g)ØTCuCl2(s)+H2O(g)”÷H3=-121kJmol-1£¬øł¾ŻøĒĖ¹¶ØĀÉ£¬(¢Ł+¢Ś+¢Ū)”Į2æɵĆ4HCl(g)+O2(g)ØT2Cl2(g)+2H2O(g)£¬¾Ż“Ė¼ĘĖćøĆ·“Ó¦µÄ”÷H£»
Cl2(g)”÷H2=-20kJmol-1£¬¢ŪCuO(s)+2HCl(g)ØTCuCl2(s)+H2O(g)”÷H3=-121kJmol-1£¬øł¾ŻøĒĖ¹¶ØĀÉ£¬(¢Ł+¢Ś+¢Ū)”Į2æɵĆ4HCl(g)+O2(g)ØT2Cl2(g)+2H2O(g)£¬¾Ż“Ė¼ĘĖćøĆ·“Ó¦µÄ”÷H£»
(3)4HCl(g)+O2(g)ØT2Cl2(g)+2H2O(g)ĪŖĘųĢåĢå»żĖõŠ”µÄ·ÅČČ·“Ó¦£¬ČōŅŖĢįøßHClµÄ×Ŗ»ÆĀŹ£¬ŠčŅŖŹ¹Ę½ŗāĻņ×ÅÕżĻņŅĘ¶Æ£¬½įŗĻĘ½ŗāŅʶÆŌĄķ·ÖĪö”£
(1)øł¾Ż·“Ó¦·½³ĢŹ½ÖŖ£¬HClĘ½ŗā×Ŗ»ÆĀŹŌ½“ó£¬Ę½ŗā³£ŹżKŌ½“󣬽įŗĻĶ¼ĻńÖŖÉżøßĪĀ¶ČĘ½ŗā×Ŗ»ÆĀŹ½µµĶ£¬ĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½Ļņ½ųŠŠ£¬ŌņK(300”ę)>K(400”ę)£»
ÓÉĶ¼ĻńÖŖ£¬400”ꏱ£¬HClĘ½ŗā×Ŗ»ÆĀŹĪŖ84%£¬ÓĆČż¶ĪŹ½·Ø¶ŌŹż¾Ż½ųŠŠ“¦ĄķµĆ£ŗ
![]()
ĘšŹ¼(ÅضČ) c0 c0 0 0
±ä»Æ(ÅضČ) 0.84c0 0.21c0 0.42c0 0.42c0
Ę½ŗā(ÅضČ)(1-0.84)c0 (1-0.21)c0 0.42c0 0.42c0
ŌņK=![]() £»øł¾ŻĢāøÉŠÅĻ¢ÖŖ£¬½ųĮĻÅØ¶Č±Č¹żµĶ£¬ŃõĘų“óĮæŹ£Óą£¬µ¼ÖĀ·ÖĄė²śĪļĀČĘųŗĶŃõĘųµÄÄÜŗĽĻøߣ»½ųĮĻÅØ¶Č±Č¹żøߣ¬HCl²»Äܳä·Ö·“Ó¦£¬µ¼ÖĀHCl×Ŗ»ÆĀŹ½ĻµĶ£»
£»øł¾ŻĢāøÉŠÅĻ¢ÖŖ£¬½ųĮĻÅØ¶Č±Č¹żµĶ£¬ŃõĘų“óĮæŹ£Óą£¬µ¼ÖĀ·ÖĄė²śĪļĀČĘųŗĶŃõĘųµÄÄÜŗĽĻøߣ»½ųĮĻÅØ¶Č±Č¹żøߣ¬HCl²»Äܳä·Ö·“Ó¦£¬µ¼ÖĀHCl×Ŗ»ÆĀŹ½ĻµĶ£»
(2)øł¾ŻøĒĖ¹¶ØĀÉÖŖ£¬(¢Ł+¢Ś+¢Ū)”Į2µĆ![]() H=(H1+H2+H3)”Į2=-116kJ”¤mol-1£»
H=(H1+H2+H3)”Į2=-116kJ”¤mol-1£»
(3)ČōĻėĢįøßHClµÄ×Ŗ»ÆĀŹ£¬Ó¦øĆ“ŁŹ¹Ę½ŗāÕżĻņŅĘ¶Æ£¬øĆ·“Ó¦ĪŖĘųĢåĢå»ż¼õŠ”µÄ·“Ó¦£¬øł¾ŻĄÕĻÄĢŲĮŠŌĄķ£¬æÉŅŌŌö“óŃ¹Ē棬Ź¹Ę½ŗāÕżĻņŅĘ¶Æ£»Ņ²æÉŅŌ¼°Ź±³żČ„²śĪļ£¬¼õŠ”²śĪļÅØ¶Č£¬Ź¹Ę½ŗāÕżĻņŅĘ¶Æ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖ“ś¹¤ŅµÉś²śÖŠ³£ÓƵē½āĀČ»ÆŃĒĢśµÄ·½·ØÖʵĆĀČ»ÆĢśČÜŅŗĪüŹÕÓŠ¶¾µÄĮņ»ÆĒāĘųĢ唣¹¤ŅÕŌĄķČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø £©
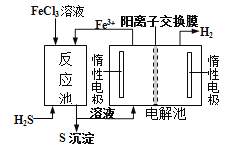
A. H+“Óµē½ā³Ų×ó²ŪĒØŅʵ½ÓŅ²Ū B. ×ó²ŪÖŠ·¢ÉśµÄ·“Ó¦ŹĒ£ŗ2Cl--2e-=Cl2”ü
C. ÓŅ²ŪµÄ·“Ó¦Ź½£ŗ 2H++2e-=H2”ü D. FeCl3ČÜŅŗæÉŅŌŃ»·ĄūÓĆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ»śĪļÖŠĶ¬·ÖŅģ¹¹ĢåŹżÄæ×ī¶ąµÄŹĒ£Ø £©
A.·Ö×ÓŹ½ĪŖC4H10µÄ¶žĀČ“śĪļ
B.·Ö×ÓŹ½ĪŖC3H9NµÄÓŠ»śĪļ£¬ĘäÖŠNŌ×ÓŅŌČżøöµ„¼üÓėĘäĖūŌ×ÓĻąĮ¬
C.·Ö×ÓŹ½ĪŖC8H10µÄ±½µÄĶ¬ĻµĪļµÄŅ»ĀČ“śĪļ
D.·Ö×ÓŹ½ĪŖC7H16µÄÓŠ»śĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠĖȤŠ”×éÉč¼ĘĮĖČēĻĀŹµŃé²ā¶Øŗ£“ųÖŠµāŌŖĖŲµÄŗ¬Į棬ŅĄ“Ī¾¹żŅŌĻĀĖÄøö²½Öč£¬Ķ¼Ź¾×°ÖĆŗĶŌĄķ ÄÜ“ļµ½ŹµŃéÄæµÄµÄŹĒ
A.×ĘÉÕŗ£“ų
B.½«ŗ£“ų»ŅČܽāŗó·ÖĄė³ö²»ČÜŠŌŌÓÖŹ
C.ÖʱøCl2£¬²¢½«I£Ńõ»ÆĪŖI2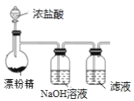
D.ŅŌµķ·ŪĪŖÖøŹ¾¼Į£¬ÓĆNa2SO3±ź×¼ČÜŅŗµĪ¶Ø
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æFeSO4 ČÜŅŗ·ÅÖĆŌŚæÕĘųÖŠČŻŅ×±äÖŹ£¬Ņņ“ĖĪŖĮĖ·½±ćŹ¹ÓĆ Fe2£«£¬ŹµŃéŹŅÖŠ³£±£“ęĮņĖįŃĒĢśļ§¾§Ģå[Ė×³Ę”°Ä¦¶ūŃĪ”±£¬»ÆѧŹ½ĪŖ(NH4)2Fe(SO4)26H2O]£¬Ėü±ČĀĢ·Æ»ņĀĢ·ÆČÜŅŗøüĪČ¶Ø”£(ĪČ¶ØŹĒÖøĪļÖŹ·ÅÖĆ ŌŚæÕĘųÖŠ²»Ņ×·¢Éśø÷ÖÖ»Æѧ·“Ó¦¶ų±äÖŹ)
I£®ĮņĖįŃĒĢśļ§¾§ĢåµÄÖʱøÓė¼ģŃé
£Ø1£©Ä³ŠĖȤŠ”×éÉč¼ĘŹµŃéÖʱøĮņĖįŃĒĢśļ§¾§Ģ唣
±¾ŹµŃéÖŠ£¬ÅäÖĘČÜŅŗŅŌ¼°ŗóŠųŹ¹ÓƵ½µÄÕōĮóĖ®¶¼±ŲŠėÖó·Š”¢ĄäČ“ŗóŌŁŹ¹ÓĆ£¬ÕāŃł“¦ĄķÕōĮóĖ®µÄÄæµÄŹĒ_______”£Ļņ FeSO4 ČÜŅŗÖŠ¼ÓČė±„ŗĶ(NH4)2SO4 ČÜŅŗ£¬¾¹ż²Ł×÷_______”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓŗĶøÉŌļŗóµĆµ½Ņ» ÖÖĒ³Ą¶ĀĢÉ«µÄ¾§Ģ唣
£Ø2£©øĆŠ”×éĶ¬Ń§¼ĢŠųÉč¼ĘŹµŃéÖ¤Ć÷ĖłÖĘµĆ¾§ĢåµÄ³É·Ö”£
¢ŁČēĶ¼ĖłŹ¾ŹµŃéµÄÄæµÄŹĒ_______£¬C ×°ÖƵÄ×÷ÓĆŹĒ_______”£
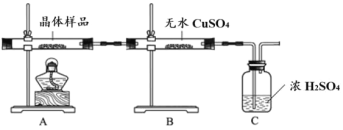
ȔɣĮ澧ĢåČÜÓŚĖ®£¬µĆµĀĢÉ«“ż²āŅŗ”£
¢ŚČ”ÉŁĮæ“ż²āŅŗ£¬_______ (Ģī²Ł×÷ÓėĻÖĻó)£¬Ö¤Ć÷ĖłÖĘµĆµÄ¾§ĢåÖŠÓŠ Fe2£«”£
¢ŪȔɣĮæ“ż²āŅŗ£¬¾ĘäĖüŹµŃéÖ¤Ć÷¾§ĢåÖŠÓŠNH4£«ŗĶSO42£
II£®ŹµŃéĢ½¾æÓ°ĻģČÜŅŗÖŠ Fe2£«ĪČ¶ØŠŌµÄŅņĖŲ
£Ø3£©ÅäÖĘ 0.8 mol/L µÄ FeSO4 ČÜŅŗ£ØpH=4.5£©ŗĶ 0.8 mol/L µÄ(NH4)2Fe(SO4)2 ČÜŅŗ£ØpH=4.0£©£¬ø÷Č” 2 ml ÉĻŹöČÜŅŗÓŚĮ½Ö§ŹŌ¹ÜÖŠ£¬øÕæŖŹ¼Į½ÖÖČÜŅŗ¶¼ŹĒĒ³ĀĢÉ«£¬·Ö±šĶ¬Ź±µĪ¼Ó 2 µĪ 0.01mol/L µÄ KSCN ČÜŅŗ£¬15 ·ÖÖÓŗó¹Ū²ģæɼū£ŗ(NH4)2Fe(SO4)2ČÜŅŗČŌČ»ĪŖĒ³ĀĢÉ«ĶøĆ÷³ĪĒåČÜŅŗ£»FeSO4ČÜŅŗŌņ³öĻÖµ»ĘÉ«»ė×Ē”£
£Ø׏ĮĻ 1£©
³Įµķ | Fe(OH)2 | Fe(OH)3 |
æŖŹ¼³ĮµķpH | 7.6 | 2.7 |
ĶźČ«³ĮµķpH | 9.6 | 3.7 |
¢ŁĒėÓĆĄė×Ó·½³ĢŹ½½āŹĶ FeSO4 ČÜŅŗ²śÉśµ»ĘÉ«»ė×ĒµÄŌŅņ_______”£
¢ŚĢÖĀŪÓ°Ļģ Fe2£«ĪČ¶ØŠŌµÄŅņĖŲ£¬Š”×éĶ¬Ń§Ģį³öŅŌĻĀ 3 ÖÖ¼ŁÉč£ŗ
¼ŁÉč 1£ŗĘäĖüĢõ¼žĻąĶ¬Ź±£¬NH4£«µÄ“ęŌŚŹ¹(NH4)2Fe(SO4)2 ČÜŅŗÖŠ Fe2+ĪČ¶ØŠŌ½ĻŗĆ”£
¼ŁÉč 2£ŗĘäĖüĢõ¼žĻąĶ¬Ź±£¬ŌŚŅ»¶Ø pH ·¶Ī§ÄŚ£¬ČÜŅŗ pH Ō½Š” Fe2£«ĪČ¶ØŠŌŌ½ŗĆ”£
¼ŁÉč 3£ŗ_______”£
£Ø4£©Š”×éĶ¬Ń§ÓĆČēĶ¼×°ÖĆ£ØGĪŖĮéĆōµēĮ÷¼Ę£©£¬µĪČėŹŹĮæµÄĮņĖįČÜŅŗ·Ö ±šæŲÖĘČÜŅŗ A£Ø0.2 mol/L NaCl£©ŗĶČÜŅŗ B£Ø0.1mol/L FeSO4£©ĪŖ²»Ķ¬µÄ pH£¬

¹Ū²ģ¼ĒĀ¼µēĮ÷¼Ę¶ĮŹż£¬¶Ō¼ŁÉč 2 ½ųŠŠŹµŃéŃŠ¾æ£¬ŹµŃé½į¹ūČē±ķĖłŹ¾”£
ŠņŗÅ | A£ŗ0.2mol”¤L£1NaCl | B£ŗ0.1mol”¤L£1FeSO4 | µēĮ÷¼Ę¶ĮŹż |
ŹµŃé1 | pH=1 | pH=5 | 8.4 |
ŹµŃé2 | pH=1 | pH=1 | 6.5 |
ŹµŃé3 | pH=6 | pH=5 | 7.8 |
ŹµŃé4 | pH=6 | pH=1 | 5.5 |
£Ø׏ĮĻ 2£©Ōµē³Ų×°ÖĆÖŠ£¬ĘäĖüĢõ¼žĻąĶ¬Ź±£¬øŗ¼«·“Ó¦ĪļµÄ»¹ŌŠŌŌ½Ēæ»ņÕż¼«·“Ó¦ĪļµÄŃõ»ÆŠŌŌ½Ē棬øĆŌ µē³ŲµÄµēĮ÷Ō½“ó”£
£Ø׏ĮĻ 3£©³£ĪĀĻĀ£¬0.1mol/L pH=1 µÄ FeSO4 ČÜŅŗ±Č pH=5 µÄ FeSO4 ČÜŅŗĪČ¶ØŠŌøüŗĆ”£ øł¾ŻŅŌÉĻŹµŃé½į¹ūŗĶ׏ĮĻŠÅĻ¢£¬¾Š”×éĢÖĀŪæÉŅŌµĆ³öŅŌĻĀ½įĀŪ£ŗ
¢ŁU ŠĶ¹ÜÖŠ×ó³ŲµÄµē¼«·“Ó¦Ź½____________”£
¢Ś¶Ō±ČŹµŃé 1 ŗĶ 2£Ø»ņ 3 ŗĶ 4£© ,ŌŚŅ»¶Ø pH ·¶Ī§ÄŚ£¬æÉµĆ³öµÄ½įĀŪĪŖ____________”£
¢Ū¶Ō±ČŹµŃé____________ŗĶ____________£¬»¹æÉµĆ³öŌŚŅ»¶ØpH ·¶Ī§ÄŚČÜŅŗĖį¼īŠŌ±ä»Æ¶Ō O2 Ńõ»ÆŠŌĒæČõµÄÓ°ĻģŅņĖŲ”£
¢Ü ¶Ō£Ø׏ĮĻ 3£©ŹµŃéŹĀŹµµÄ½āŹĶĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
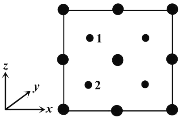
”¾ĢāÄæ”æ2020Äź2ŌĀ15ČÕ£¬Óɹś¼ŅæĘŃŠ¹„¹Ų×éµÄÖ÷ŅŖ³ÉŌ±µ„Ī»µÄ×ؼŅ×é¹²Ķ¬ŃŠÅŠĮ×ĖįĀČąŌŚĻø°ūĖ®Ę½ÉĻÄÜÓŠŠ§ŅÖÖĘŠĀŠĶ¹Ś×“²”¶¾(SARS£CoV£2)µÄøŠČ¾”£Į×ĖįĀČąµÄ½į¹¹ČēĶ¼ĖłŹ¾£¬¾Ż“Ė»Ų“šĻĀĮŠĪŹĢā”£
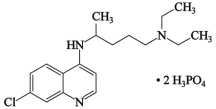
(1)C”¢N”¢OČżÖÖŌŖĖŲµŚŅ»µēĄėÄܓӓ󵽊”µÄĖ³ŠņĪŖ_____________£»µēøŗŠŌ¦Ö(P)_____¦Ö(Cl)(Ģī”°£¾”±»ņ”°£¼”±)£»
(2)Į×ĖįĀČąÖŠNŌ×ÓµÄŌӻƷ½Ź½ĪŖ_____£¬NH3ŹĒŅ»ÖÖ¼«Ņ×ČÜÓŚĖ®µÄĘųĢ壬Ęä·Šµć±ČAsH3µÄ·Šµćøߣ¬ĘäŌŅņŹĒ___________£»
(3)Į×»ÆļŲÓėÉé»ÆļŲŹĒĮ½ÖÖÓÉ¢óA×åŌŖĖŲÓė¢õA×åŌŖĖŲČĖ¹¤ŗĻ³ÉµÄ¢ó£¢õ×å»ÆŗĻĪļ°ėµ¼Ģå²ÄĮĻ”£Ę侧°ū½į¹¹æÉæ“×÷½šøÕŹÆ¾§°ūÄŚ²æµÄĢ¼Ō×Ó±»P(As)Ō×Ó“śĢę£¬¶„µćŗĶĆęŠÄµÄĢ¼Ō×Ó±»GaŌ×Ó“śĢę”£
¢Ł»łĢ¬GaŌ×ÓŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ__________£»
¢ŚÉé»ÆļŲ¾§ĢåÖŠŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶĪŖ___________(ĢīŃ”Ļī×ÖÄø)£»
A.Ąė×Ó¼ü B.ÅäĪ»¼ü C.¦Ņ¼ü D.¦Š¼ü E.¼«ŠŌ¼ü F.·Ē¼«ŠŌ¼ü
¢ŪĮ×»ÆļŲÓėÉé»ÆļŲ¾ßÓŠĻąĖĘµÄ¾§Ģå½į¹¹£¬ĘäÖŠČŪµć½ĻøߵďĒ__________(Ģī»ÆѧŹ½)£¬ŌŅņŹĒ_______________£»
¢ÜŅŌ¾§°ū²ĪŹżĪŖµ„Ī»³¤¶Č½ØĮ¢µÄ×ų±źĻµæÉŅŌ±ķŹ¾¾§°ūÖŠø÷Ō×ÓµÄĪ»ÖĆ”£³Ę×÷Ō×Ó·ÖŹż×ų±ź”£ČēĶ¼ĪŖŃŲyÖįĶ¶Ó°µÄĮ×»ÆļŲ¾§°ūÖŠĖłÓŠŌ×ӵķֲ¼Ķ¼”£ČōŌ×Ó1µÄŌ×Ó·ÖŹż×ų±źĪŖ(0.25£¬0.25£¬0.75)£¬ŌņŌ×Ó2µÄŌ×Ó·ÖŹż×ų±źĪŖ__________£»ČōĮ×»ÆļŲµÄ¾§ĢåĆܶČĪŖ¦Ń g”¤cm£3£¬°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµĪŖNA£¬Ōņ¾§°ūÖŠGaŗĶPŌ×ÓµÄ×ī½ü¾ąĄėĪŖ__________ pm(ÓĆ“śŹżŹ½±ķŹ¾)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ![]() ĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
ĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. 0.1 mol µÄ![]() ÖŠ£¬ŗ¬ÓŠ
ÖŠ£¬ŗ¬ÓŠ![]() øöÖŠ×Ó
øöÖŠ×Ó
B. pH=1µÄH3PO4ČÜŅŗÖŠ£¬ŗ¬ÓŠ![]() øö
øö![]()
C. 2.24L£Ø±ź×¼×“æö£©±½ŌŚO2ÖŠĶźČ«Č¼ÉÕ£¬µĆµ½![]() øöCO2·Ö×Ó
øöCO2·Ö×Ó
D. ĆܱÕČŻĘ÷ÖŠ1 mol PCl3Óė1 mol Cl2·“Ó¦Öʱø PCl5£Øg£©£¬Ōö¼Ó![]() øöP-Cl¼ü
øöP-Cl¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ŹĒŅ»ÖÖ×ŪŗĻ“¦ĄķSO2·ĻĘųµÄ¹¤ŅÕĮ÷³Ģ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©

A.ĻņBČÜŅŗÖŠµĪ¼ÓKSCNČÜŅŗ£¬ČÜŅŗæÉÄܱäĪŖŗģÉ«
B.ČÜŅŗB×Ŗ»ÆĪŖČÜŅŗC·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ4H£«£«2Fe2£«£«O2=2Fe3£«£«2H2O
C.ČÜŅŗĖįŠŌ£ŗA>B
D.¼ÓŃõ»ÆŃĒĢśæÉŅŌŹ¹ČÜŅŗC×Ŗ»ÆĪŖČÜŅŗA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£Øb£©![]() ”¢£Ød£©
”¢£Ød£©![]() ”¢£Øp£©
”¢£Øp£©![]() µÄ·Ö×ÓŹ½¾łĪŖC6H6£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
µÄ·Ö×ÓŹ½¾łĪŖC6H6£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. bµÄĶ¬·ÖŅģ¹¹ĢåÖ»ÓŠdŗĶpĮ½ÖÖB. b”¢d”¢pµÄ¶žĀČ“śĪļ¾łÖ»ÓŠČżÖÖ
C. b”¢d”¢p¾łæÉÓėĖįŠŌøßĆĢĖį¼ŲČÜŅŗ·“Ó¦D. b”¢d”¢pÖŠÖ»ÓŠbµÄĖłÓŠŌ×Ó“¦ÓŚĶ¬Ņ»Ę½Ćę
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com