
| A. | H218O 的摩尔质量为20g?mol-1 | |
| B. | 铁粉溶于盐酸的化学方程式:2Fe+6HCl=2FeCl3+3H2↑ | |
| C. | 氯离子的结构示意图: | |
| D. | 乙醇的分子式为CH3CH2OH |
分析 A.摩尔质量以g/mol为单质,数值上与相对分子质量相等;
B.不符合反应客观事实;
C.氯离子核内有17个质子,核外有18个电子;
D.CH3CH2OH为乙醇的结构简式,分子式为:C2H6O;
解答 解:A.H218O的相对分子质量为20,所以H218O 的摩尔质量为20g?mol-1,故A正确
B.铁粉溶于盐酸的化学方程式,离子方程式:Fe+2HCl=FeCl2+H2↑,故B错误;
C.氯离子核内有17个质子,氯离子核外有3个电子层,18个电子,结构示意图 ,故C错误;
,故C错误;
D.CH3CH2OH为乙醇的结构简式,分子式为:C2H6O,故D错误;
故选:A.
点评 本题考查了化学用语的使用,明确摩尔质量与相对分子质量的关系,熟悉原子结构示意图、分子式、结构简式使用方法是解题关键,有利于学生规范使用化学用语的习惯,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2LCO和2LCO2 | B. | 9g H2O和标准状况下11.2LCO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和22.4LHCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯酸钾是还原剂 | |
| B. | KCl既是氧化产物,又是还原产物 | |
| C. | 反应中消耗3mol P时,转移电子的物质的量为15mol | |
| D. | 发令时产生的白烟只是KCl固体颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夜里的月色本身就很美 | |
| B. | 空气中的小水滴颗粒直径约为1nm-100nm | |
| C. | 光线是一种胶体 | |
| D. | 雾是一种胶体,能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56gFe与足量的盐酸反应,转移的电子数为2NA | |
| B. | 标准状况下,22.4L的水中含有的原子数为3NA | |
| C. | 物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| D. | 22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
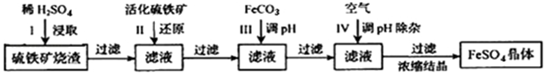
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
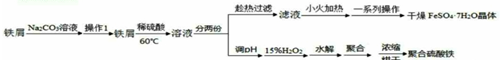
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com