
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氨气是弱电解质,铜是强电解质 | |
| C. | 体积和氢离子浓度都相同的盐酸和醋酸溶液中和同种NaOH溶液,消耗氢氧化钠一样多 | |
| D. | 等浓度等体积的盐酸和醋酸溶液中和同种NaOH溶液,消耗氢氧化钠一样多 |
分析 A.溶液导电能力由溶液中离子浓度大小决定,与电解质强弱无关;
B.在水溶液或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质;
C.醋酸为弱酸,两种溶液中H+离子浓度相等,则醋酸浓度大于盐酸;
D.相同物质的量的一元强酸和弱酸中和碱的能力相同.
解答 解:A.溶液导电能力由溶液中离子浓度大小决定,与电解质强弱无关,如强电解质硫酸钡难溶于水,其水溶液的浓度很小,导电性很弱,故A错误;
B.氨气是非电解质,Cu是金属单质既不是电解质又不是非电解质,故B错误;
C.醋酸为弱酸,两种溶液中H+离子浓度相等,则醋酸浓度大于盐酸,所以中和同种NaOH溶液,醋酸消耗的NaOH多,故C错误;
D.相同物质的量的一元强酸和弱酸中和碱的能力相同,所以相同体积、相同物质的量浓度的盐酸与醋酸溶液,消耗氢氧化钠一样多,故D正确.
故选D.
点评 本题考查了溶液的导电性、电解质和非电解质的概念、弱电解质的电离特点等,题目难度不大,明确醋酸为弱电解质的特点、以及电解质的概念是解题的关键.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
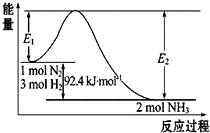 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H的电子式为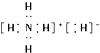 | |
| B. | 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数的数值) | |
| C. | NH4H中的H-半径比锂离子半径大 | |
| D. | NH4H晶体既有共价键又有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 在标准状况下22.4L SO3有4NA个原子 | |
| C. | 标准状况下,22.4LNO与11.2LO2混合后气体的分子数为2NA | |
| D. | 7.8g Na2S和Na2O2的混合物中所含离子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb为正极被氧化 | B. | SO42-只向PbO2处移动 | ||
| C. | Pb电极质量减少 | D. | 电解质溶液的pH不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,此反应类型为:取代反应.
,此反应类型为:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时吸热,可作制冷剂 | |
| B. | 氧化铝熔点高,可作耐火材料 | |
| C. | 利用酒精沸点较低,可作消毒杀菌剂 | |
| D. | 利用CO2合成的聚碳酸酯能水解,可作降解塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
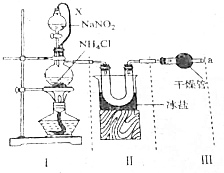 氮气、氨及铵盐用途非常广泛.回答下列问题:
氮气、氨及铵盐用途非常广泛.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com