
【题目】第二代复合火箭推进剂发生的反应可表示为:①2NH4ClO4→N2↑+Cl2↑+2O2↑+4H2O;②4Al(s)+3O2(g)→2Al2O3(s)+QkJ(Q>0)。完成下列填空:
(1)书写H2O的电子式____________________,Cl原子核外有______种不同能量的电子。
(2)上述物质所形成的晶体中,只包含一种微粒间作用力的是________(填序号)。
a. N2 b. Al2O3 c. H2O d. NH4ClO4
(3)N2和O2都能与H2反应,但二者反应条件差异较大,分析可能原因:①从分子断键角度看,N2分子更难断键,原因是_________________________________;②从原子成键角度看,O原子更易与H原子结合,原因是______________________________________________。
(4)反应①中,氧化产物是_______;生成1molN2时,反应中转移_______NA电子。铵盐都易分解,NH4Cl、NH4HCO4等受热分解得到NH3和相应的酸,而NH4NO3等铵盐和NH4ClO4分解相似,一般无法得到对应酸,且产物可能为N2或NO等物质。请分析不同铵盐受热分解产物存在差异的可能原因:__________。
(5)下列能量变化示意图可与反应②中所体现的能量关系匹配的是________(填序号)。
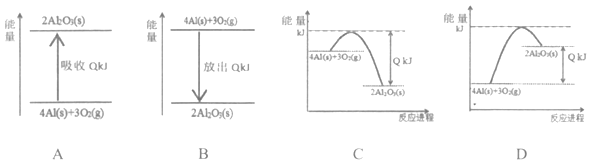
【答案】![]() 5 b N2分子中存在三键,键能很大 O原子半径更小,吸引电子的能力更强 N2和O2 14 形成铵盐的酸的特性不同 B
5 b N2分子中存在三键,键能很大 O原子半径更小,吸引电子的能力更强 N2和O2 14 形成铵盐的酸的特性不同 B
【解析】
(1)水为共价化合物形成共价键,氯原子核外17个电子,有17种运动状态,不同能量的电子利用电子排布式判断;
(2)晶体中存在微粒间作用力主要有化学键、分子间作用力;
(3)氮气分子中形成氮氮三键,键能大不容易破坏,性质稳定,氧原子原子半径小于氮原子,吸引电子能力强;
(4)反应中元素化合价升高的失电子发生氧化反应得到氧化产物,结合电子守恒计算电子转移总数,铵盐分解生成的酸的稳定性不同,反应得到产物不同;
(5)反应②4Al(s)+3O2(g)=2Al2O3(s)+QkJ(Q>0)是放热反应,反应物能量高于生成物,反应放出的能量是生成物总能量﹣反应物总能量。
(1)水为共价化合物,电子式为:![]() ,氯原子电子排布式为1s22s22p63s23p5,原子核外有5种不同能量的电子;
,氯原子电子排布式为1s22s22p63s23p5,原子核外有5种不同能量的电子;
(2)a.N2存在的微粒间作用力为共价键、分子间作用力,故a不符合;
b.Al2O3 是离子化合物,存在离子键,只包含一种微粒间作用力,故b符合;
c.H2O微粒间存在分子间作用力、共价键,故c不符合;
d.NH4ClO4存在离子键、共价键,故d不符合;
故答案为b;
(3)N2和O2都能与H2反应,但二者反应条件差异较大,分析可能原因:①从分子断键角度看,N2分子更难断键,原因是氮气分子中含有三键,键能大,②从原子成键角度看,O原子更易与H原子结合,原因是氧原子半径小吸引电子的能力强;
(4)①2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O,反应中氮元素化合价﹣3价升高为0价,氧元素化合价﹣2价升高为0价,化合价升高失电子发生氧化反应得到氧化产物,氧化产物是N2、O2,生成1molN2时,反应中转移电子总数为14mol;形成铵盐的酸的特性不同,导致不同酸的铵盐分解产物存在差异。
(5)反应②4Al(s)+3O2(g)=2Al2O3(s)+QkJ(Q>0)是放热反应,反应物能量高于生成物;
A.是吸热反应不符合,故A错误;
B.能量变化表示为反应物能量高于生成物,反应为放热反应,故B正确;
C.反应放出的热量生成物总能量﹣反应物总能量,图象不符合,故C错误;
D.物质能量变化为吸热反应,故D错误;
故答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中不正确的是

A. a极应与X连接
B. N电极发生还原反应,当N电极消耗11.2 L(标准状况下) O2时,则a电极增重64 g
C. 不论b为何种电极材料,b极的电极反应式一定为2Cl--2e-=Cl2↑
D. 若废水中含有乙醛,则M极的电极反应为:CH3CHO+3H2O-10e-=2CO2↑+10H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有1mol原子的氢气在标准状况下的体积约为22.4 L
B.25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
C.1 mol/L的Na2SO4溶液含Na+数为2 NA
D.标准状况下,11.2 L H2O含有的分子数为9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
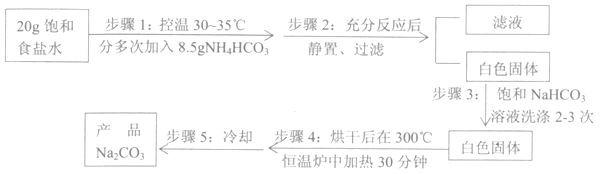
【题目】Na2CO3是重要的化工原料,工业上采用NH3、CO2、NaCl为原料来制备。某兴趣小组用NH4HCO3固体替换NH3和CO2,按照下列流程在实验室模拟制备Na2CO3。
完成下列填空:
(1)步骤1中,为控制反应温度在30~35℃,应选用的加热方式是_______________;实验前NH4HCO3固体须在____________里(填仪器名称)磨成粉末,且加入时要不断搅拌,这些操作的目的是_____________________________________________________________。
(2)步骤3中,使用饱和NaHCO3溶液洗涤白色固体的原因是____________________________。
(3)步骤4中,恒温炉内发生的化学反应为______________________________(书写化学方程式)。
为检验产品纯度,该小组按如下流程操作:
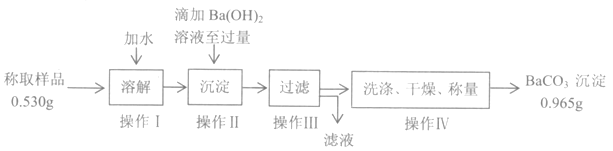
(4)判断操作II中滴加Ba(OH)2溶液是否过量的方法是___________________________________。
(5)若样品中杂质不与Ba(OH)2反应,则Na2CO3的质量分数为____________(小数点后保留两位)。
(6)若样品中所含杂质是NaHCO3、NaCl中的一种或两种,①如何确定样品中是否含有NaCl,设计实验方案_________________________________________________________________。
②有同学认为,根据上述实验数据就可以判断出样品中一定含有NaCl,无需再实验检验,判断的理由是____________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如图装置研究电化学反应,a、b可用导线连接。下列叙述错误的是
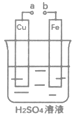
A. a、b不连接时,铁片上有气泡产生
B. a、b连接时,铜片上发生反应:2H++2e→H2↑
C. a、b连接时,溶液中产生电子的定向移动
D. 无论a和b是否连接,铁片上都会发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:

已知:①浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度≤1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有________ (填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为___________________________________。
(3)“还原”时,被Sb还原的物质为________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于_____;所加Na2S也不宜过多,其原因为_________________________________。
(5)“除砷”时有H3PO3生成,该反应的化学方程式为________________________________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C的原子半径在所有短周期主族元素中最大,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005 mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述一定正确的是

A. C、D两元素形成的化合物的原子个数比为1:2
B. C、E形成的化合物的水溶液呈碱性
C. 简单离子半径:D> C> B
D. 最高价氧化物对应水化物的酸性:E>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的一氯代物只有4种
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:
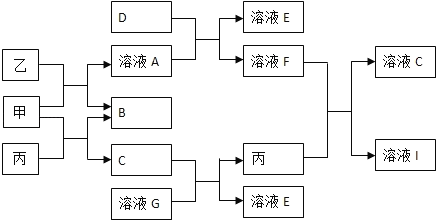
(1)甲物质为____________(填化学式)。
(2)乙与甲反应的化学方程式为____________,丙与甲反应的化学方程式为____________。
(3)D能使湿润的有色布条褪色,其褪色原因是____________(结合化学反应方程式描述原因)。
(4)D可用于制取“84”消毒液,反应的化学方程式为____________,也可用于工业上制取漂白粉,反应的化学方程式为____________,但漂白粉保存不当易变质,变质时涉及到的化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com